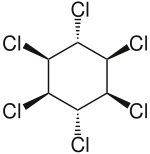
Lindan
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lindan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
Summenformel | C6H6Cl6 | ||||||||||||||||||
| Kurzbeschreibung | farb- und geruchloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
ATC-Code | P03AB02 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
Molare Masse | 290,83 g·mol−1 | ||||||||||||||||||
Aggregatzustand | fest | ||||||||||||||||||
Dichte | 1,85 g·cm−3[1] | ||||||||||||||||||
Schmelzpunkt | 112,9 °C[1] | ||||||||||||||||||
Siedepunkt | 323 °C (Zersetzung)[1] | ||||||||||||||||||
Dampfdruck | ca. 0,04 Pa (20 °C)[2] | ||||||||||||||||||
Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
MAK | DFG/Schweiz: 0,1 mg·m−3 (gemessen als einatembarer Staub)[1][4] | ||||||||||||||||||
Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Lindan beziehungsweise γ-Hexachlorcyclohexan ist ein Halogenkohlenwasserstoff, der vor allem als Insektizid genutzt wird.
Inhaltsverzeichnis
1 Geschichte
2 Synthese
3 Reaktionsverhalten
4 Verwendung
5 Gefahrenpotential
5.1 Altlasten
6 Analytischer Nachweis
7 Holzschutzmittel-Prozess
8 Einzelnachweise
Geschichte |
Lindan wurde erstmals 1825 durch Michael Faraday hergestellt. Benannt ist es nach dem niederländischen Chemiker Teunis van der Linden (1884–1965), der 1912 das γ-Hexachlorcyclohexan erstmals isoliert und beschrieben hatte.
Die insektizide Wirkung von Hexachlorcyclohexan wurde 1935 entdeckt, anscheinend parallel bei der britischen Imperial Chemical Industries und durch den französischen Chemiker André Dupire, teilweise wird auch Marc Raucourt vom Agrarforschungszentrum in Versailles als Mitentdecker angegeben.[6] Seit 1942 wird Lindan als Insektizid eingesetzt. In der Schweiz verwendete man von 1946 an ein Hexachlorcyclohexan (HCH)-Isomerengemisch. Bald stellte sich heraus, dass Rüben, Kartoffeln und Kohl durch die Anwendung von HCH einen modrigen Geschmack bekamen, der sie ungenießbar machte. Da die Geschmacksbeeinträchtigung nicht vom γ-HCH, sondern von anderen HCH-Isomeren ausging, wurden Verfahren entwickelt, um reines Lindan zu isolieren. 1950 konnte in der Schweiz die Herstellung von Lindan aufgenommen werden. Die damals zuständigen eidgenössischen Versuchsanstalten zogen 1952 die Zulassungen für Pflanzenschutzmittel auf HCH-Basis zurück.[6] Nach einem Höhepunkt um 1969 ging die Produktion von Lindan weltweit zurück. In Deutschland darf Lindan seit 1980 nur mehr in Form von isomerenreinem Gamma-Hexachlorcyclohexan als Fraß- und Kontaktgift eingesetzt werden. Die früher mitausgebrachten Alpha- und Beta-Isomere (CAS-Nummer: 319-84-6, 319-85-7) erwiesen sich als toxischer und noch schwerer abbaubar als die ebenfalls nicht unproblematische Gamma-Struktur. Lindan wird seit 1984 in der BRD, seit 1989 in der damaligen DDR nicht mehr hergestellt, wird aber im Ausland noch verwendet. In den Staaten der EU und in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[7]
Synthese |
Hexachlorcyclohexan wird durch additive Photochlorierung von Benzol hergestellt. Ein Überschuss an Chlor wird in Benzol gelöst und mit energiereichem UV-Licht bestrahlt. Das Reaktionsprodukt ist ein Gemisch verschiedener Isomere, von denen alleine Gamma-Hexachlorcyclohexan insektizide Eigenschaften aufweist. Der Anteil dieses Isomers beträgt nur 15 %. Zur Isolierung wird das Isomeren-Gemisch mit Methanol extrahiert, woraufhin vor allem γ-Hexachlorcyclohexan in Lösung geht. Über mehrere Kristallisationsprozesse wird schließlich eine Reinheit von 99,5 % erreicht. Die unerwünschten Isomere werden seit Beginn der 1970er-Jahre in einem pyrolytischen Verfahren zu Trichlorbenzol umgewandelt.

α-Hexachlor-
cyclohexan

β-Hexachlor-
cyclohexan
Reaktionsverhalten |
Bei Hitzeeinwirkung zersetzt sich Lindan zu einem giftigen, korrosiven Dampfgemisch aus Chlorwasserstoff und Phosgen. Bei Kontakt mit Metallpulver (Aluminium, Eisen, Zink) zersetzt sich Lindan unter Bildung von Trichlorbenzol.
Verwendung |
Lindan wurde früher als Insektizid in der Land- und Forstwirtschaft eingesetzt, beispielsweise zur Bekämpfung von Engerlingen und gegen Schädlinge an Raps und Kohl.[6] Ein weiteres wichtiges Einsatzfeld waren die Holzschutzmittel, beispielsweise waren Lindan und PCP in den Holzschutzmitteln Xylamon BV und Xyladecor[8] enthalten. Daneben wird es in etwa einprozentiger Verdünnung in der Medizin als äußerliches Medikament gegen Hautparasiten, vornehmlich bei Krätze, Filzläusen und Pedikulosen, genutzt. Nach der EU-Verordnung 850/2004 durfte Lindan nur noch bis Ende 2007 in der Europäischen Union als Insektizid eingesetzt werden.
Gefahrenpotential |
Die Internationale Agentur für Krebsforschung (IARC) der WHO stufte Lindan im Jahr 2015 als „krebserregend bei Menschen“ (Gruppe 1) ein.[9]
Lindan neigt zu starker Adsorption, z. B. an Algen,[10] und ist für Wasserorganismen giftig. Da es nur langsam abgebaut wird und relativ stark lipophil ist, reichert es sich vor allem über Fische stark in der Nahrungskette des Menschen an.[11] Lindan darf daher ungebunden unter keinen Umständen in die Umwelt gelangen. Zusammen mit anderen Insektiziden auf Basis chlorierter Kohlenwasserstoffe wird Lindan auch als Mitauslöser der Parkinson-Krankheit diskutiert.[12]
Lindan steht ferner im Verdacht, bei Überschreitung der Normalwerte schwere Krankheiten auslösen zu können: Veränderung der inneren Organe, der Blutbildung, Multiple Sklerose, Nervenschädigungen. Betroffen sind nicht nur Landwirte, Handwerker und Chemiearbeiter, sondern auch Hausbewohner, die dem als Holzschutzmittel verwendeten Lindan über die Atemluft ausgesetzt sind. Einem Urteil des Oberlandesgerichts Nürnberg zufolge stellt Lindan eine nicht zu vernachlässigende Gesundheitsgefahr dar, wenn die Lindan-Konzentration im Blut 0,08–0,10 pg/l übersteige.
Altlasten |
Es wird geschätzt, dass bei der Herstellung von Lindan während sechzig Jahren weltweit zwischen vier und sieben Millionen Tonnen an Abfall angefallen ist. Dieser besteht zu rund 80 % aus α-HCH und zu einem geringeren Anteil aus β-HCH. Ein Teil dieses Abfalls lagert in offenen Deponien.[13]
Im schleswig-holsteinischen Barsbüttel war eine ehemalige Deponie belastet. In der ehemaligen DDR sind große Teile der Mulde- und Elbeauen im Raum Bitterfeld/Dessau stark mit Lindan-Rückständen belastet.
Im Grenzgebiet bei Basel, Elsass (Département Haut-Rhin) und Weil/Lörrach (sogenanntes Dreyeckland) wurde eine unbekannte Menge aus 100.000 Tonnen Lindan-Produktionsrückständen der Firma Ugine-Kuhlmann (Huningue) unter anderem in Staubform als Beton-Zuschlagstoff „entsorgt“. Aufgrund der Geruchsbelästigung von der betroffenen Bevölkerung nicht als Straßenbelag akzeptiert, wurde der „HCH-Beton“ z. B. der örtlichen Landwirtschaft zur Befestigung von Feldwegen geschenkt; Proben weisen einen HCH-Gehalt von bis zu 75 % auf. Mittlerweile ist das HCH lokal in Grund- und Oberflächenwasser nachweisbar; trotz der nun 40-jährigen Verweildauer im Freien ist es immer noch geruchlich wahrnehmbar.[14]
Heute stellen mit Lindan behandelte Hölzer in vielen Gebäuden einen ernstzunehmenden Gebäudeschadstoff dar, der nicht selten aufwendig saniert werden muss.
Analytischer Nachweis |
Der chemisch-analytische Nachweis in Umweltproben, Lebens- und Futtermitteln erfolgt nach geeigneter Probenvorbereitung zur Abtrennung der Matrix und gaschromatographischer Abtrennung von Nebenkomponenten mittels hochauflösender massenspektrometrischer Techniken wie der Flugzeitmassenspektrometrie (Time-Of-Flight-Massenspektrometrie).[15]
Holzschutzmittel-Prozess |
Aufgrund der Toxizität, insbesondere beim Einatmen von Holzschutzmitteln (u. a. Xylamon BV, Xyladecor) in Verbindung mit Pentachlorphenol, kam es zu schweren Erkrankungen bei Menschen. Dies wurde im Frankfurter Holzschutzmittelprozess von 1991 bis 1993 behandelt.[16][17], dem größten Umwelt-Strafprozess der Bundesrepublik.[18]Erich Schöndorf war hierbei der zuständige Staatsanwalt; Wolfgang Huber als Gutachter tätig. In seinem Bericht legt er den Zusammenhang zwischen bioziden Inhaltsstoffen diverser Holzschutzmittel und den daraus resultierenden Immunstörungen dar.[19]
Einzelnachweise |
↑ abcdefg Eintrag zu Lindan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016 (JavaScript erforderlich).
↑ abc Eintrag zu Lindan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
↑ Eintrag zu γ-HCH or γ-BHC im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
↑ Schweizerische Unfallversicherungsanstalt (SUVA): Grenzwerte am Arbeitsplatz 2015 – MAK-Werte, BAT-Werte, Grenzwerte für physikalische Einwirkungen, abgerufen am 2. November 2015.
↑ ab Institut für Veterinärpharmakologie und -toxikologie, Zürich.
↑ abc Lukas Straumann: Nützliche Schädlinge. Chronos Verlag, Zürich, 2005, S. 272–277, ISBN 3-0340-0695-0.
↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Lindane in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands; abgerufen am 26. März 2016.
↑ DER SPIEGEL: In Xylamon baden, 22/1993.
↑ IARC Monographs evaluate DDT, lindane, and 2,4-D, 23. Juni 2015.
↑ A. Trautmann, B. Streit: Sorption von Lindan (gamma-Hexachlorcyclohexan) an Nitzschia actinastroides (LEMM.) v. GOOR (Diatomeae) unter verschiedenen Wachstumsbedingungen. Arch. Hydrobiol./ Suppl. 55: 349–372 (1979).
↑ Bruno Streit: Uptake, accumulation and release of organic pesticides by benthic invertebrates. 3. Distribution of 14C-atrazine and 14C-lindane in an experimental 3-step food chain microcosm. Arch. Hydrobiol./ Suppl. 55: 374–400 (1979).
↑ Parkinson'sche Erkrankung eines Landwirts durch Pestizide als Berufskrankheit anerkannt
↑ John Vijgen, P. C. Abhilash, Yi Fan Li, Rup Lal, Martin Forter, Joao Torres, Nandita Singh, Mohammad Yunus, Chongguo Tian, Andreas Schäffer, Roland Weber: Hexachlorocyclohexane (HCH) as new Stockholm Convention POPs—a global perspective on the management of Lindane and its waste isomers. In: Environmental Science and Pollution Research. 18, 2011, S. 152–162, doi:10.1007/s11356-010-0417-9.
↑ Badische Zeitung, Annette Mahro, badische-zeitung.de: Chemiemüll im Elsass sorgt für Unbehagen im Dreiländereck, 9. Februar 2015.
↑ Eric J. Reiner, Adrienne R. Boden, Tony Chen, Karen A. MacPherson und Alina M. Muscalu: Advances in the Analysis of Persistent Halogenated Organic Compounds. In: LC GC Europe. 23 (2010) 60–70.
↑ SWR-betrifft: Die Holzschutzmittel-Opfer – Legal vergiftet, dann vergessen.
↑ Coalition against BAYER Dangers.
↑ Langlebiges Gift im Holzschutzmittel, Artikel der Lausitzer Rundschau
↑ Das Urteil im Frankfurter Holzschutzmittelprozeß
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |




