Kalium
| Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
[Ar] 4s1 19K Periodensystem | |||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | |||||||||||||||||||||||||||||||||||||||||||||||||
Name, Symbol, Ordnungszahl | Kalium, K, 19 | ||||||||||||||||||||||||||||||||||||||||||||||||
Serie | Alkalimetalle | ||||||||||||||||||||||||||||||||||||||||||||||||
Gruppe, Periode, Block | 1, 4, s | ||||||||||||||||||||||||||||||||||||||||||||||||
Aussehen | silbrig weiß | ||||||||||||||||||||||||||||||||||||||||||||||||
CAS-Nummer | 7440-09-7 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 2,41 %[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
Atommasse | 39,0983(1)[3]u | ||||||||||||||||||||||||||||||||||||||||||||||||
Atomradius (berechnet) | 220 (243) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
Kovalenter Radius | 203 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
Van-der-Waals-Radius | 275 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
Elektronenkonfiguration | [Ar] 4s1 | ||||||||||||||||||||||||||||||||||||||||||||||||
Austrittsarbeit | 2,30 eV[4] | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 418,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
Aggregatzustand | fest | ||||||||||||||||||||||||||||||||||||||||||||||||
Kristallstruktur | kubisch raumzentriert | ||||||||||||||||||||||||||||||||||||||||||||||||
Dichte | 0,856 g/cm3 (20 °C)[5] | ||||||||||||||||||||||||||||||||||||||||||||||||
Mohshärte | 0,4 | ||||||||||||||||||||||||||||||||||||||||||||||||
Magnetismus | paramagnetisch (Χm = 5,7 · 10−6)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||
Schmelzpunkt | 336,53 K (63,38 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
Siedepunkt | 1047 K[7] (774 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||
Molares Volumen | 45,94 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
Verdampfungswärme | 79,1 kJ/mol[7] | ||||||||||||||||||||||||||||||||||||||||||||||||
Schmelzwärme | 2,334 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||
Schallgeschwindigkeit | 2000 m/s bei 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
Spezifische Wärmekapazität | 757,8[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
Elektrische Leitfähigkeit | 14,3 · 106 A/(V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
Wärmeleitfähigkeit | 100 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch [2] | |||||||||||||||||||||||||||||||||||||||||||||||||
Oxidationszustände | −1, +1 | ||||||||||||||||||||||||||||||||||||||||||||||||
Oxide (Basizität) | K2O (stark basisch) | ||||||||||||||||||||||||||||||||||||||||||||||||
Normalpotential | −2,931 V (K++ e− → K)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||
Elektronegativität | 0,82 (Pauling-Skala) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | |||||||||||||||||||||||||||||||||||||||||||||||||
NMR-Eigenschaften | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||||||||||||||||||||||||||||||||
Kalium (lateinisch, aus arabisch القلية, DMG al-qalya ‚Pflanzenasche‘) ist ein chemisches Element mit dem Elementsymbol K und der Ordnungszahl 19. Im Periodensystem steht es in der ersten Hauptgruppe bzw. der 1. IUPAC-Gruppe und zählt zu den Alkalimetallen.
In der Erdhülle gehört Kalium zu den zehn häufigsten Elementen und kommt in zahlreichen Mineralen der Erdkruste vor.
Inhaltsverzeichnis
1 Geschichte
2 Vorkommen
3 Gewinnung und Darstellung
4 Eigenschaften
5 Verwendung
6 Biologische Bedeutung
6.1 Bedeutung als Düngemittel
6.2 Bedeutung für den menschlichen Körper
6.2.1 Empfohlene und tatsächliche Kaliumzufuhr
6.2.2 Bedeutung des Natrium/Kalium-Verhältnisses
6.2.3 Physiologische Bedeutung
6.2.4 Kaliumgehalte in Lebensmitteln
6.3 Radioaktivität
7 Kaliumnachweis
8 Verbindungen
8.1 Oxide, Hydroxide, Carbonate
8.2 Halogenide
8.3 Salze von Sauerstoffsäuren
8.4 Weitere Verbindungen
9 Einzelnachweise
10 Weblinks
Geschichte |

Humphry Davy, Entdecker des Kaliums

Kalium unter Tetrahydrofuran
Am 19. November 1807 berichtete Humphry Davy vor der Royal Society in London, es sei ihm gelungen, durch Elektrolyse von schwach angefeuchteten Ätzalkalien zwei verschiedene Metalle zu gewinnen; das eine, am 6. Oktober 1807 erstmals gewonnene Metall nannte er Potassium (die noch heute geltende englische und französische Bezeichnung für Kalium), weil man es aus Pottasche gewinnen kann, das andere, wenige Tage später erstmals gewonnene, Sodium (die noch heute geltende englische und französische Bezeichnung für Natrium), weil es in den verschiedenen Modifikationen von Natriumcarbonat (Soda) enthalten ist.
Im deutschen Sprachraum wird das Sodium Davys seit 1811 nach einem Vorschlag von Berzelius als Natrium bezeichnet, während man für das Potassium Davys den von Klaproth 1796 eingeführten Ausdruck Kalium (von arab. القَلْيَة al-qalya = Asche, aus Pflanzenasche gewinnbar) übernahm.
Vorkommen |
Kalium kommt in der Natur nur als Kation in Kaliumverbindungen vor. Das liegt daran, dass es nur ein Außenelektron besitzt und dieses sehr bereitwillig abgibt, um eine stabile und energiearme äußere Elektronenschale zu erlangen. Kovalente Kaliumverbindungen sind daher nicht bekannt.
Im Meerwasser liegt die durchschnittliche Konzentration bei 399,1 mg K+/kg = 408,4 mg K+/l.
Natürlich vorkommende kaliumhaltige Minerale sind:
Sylvin – KCl
Sylvinit – KCl · NaCl
Carnallit – KCl · MgCl2 · 6 H2O
Kainit – KCl · MgSO4 · 3 H2O
Schönit – K2SO4 · MgSO4 · 6 H2O
Polyhalit – K2SO4 · MgSO4 · MgSO4 · 2 CaSO4
Orthoklas (Kalifeldspat) – K[AlSi3O8]
Muskovit (Kaliglimmer) – KAl2(OH,F)2[AlSi3O10]
2010 wurde Kalium in der Atmosphäre von Exoplaneten XO-2b und HD 80606 b detektiert.[11][12]
Gewinnung und Darstellung |
Die Gewinnung von metallischem Kalium kann nach mehreren Verfahren erfolgen. Genutzt wurden elektrolytische Verfahren wie das Degussa-Verfahren oder ein thermisches Verfahren der I.G. Farben, Werk Griesheim. Das meiste Kalium wird jedoch mit dem in den 1950er-Jahren von Mine Safety Appliances eingeführten MSA-Verfahren hergestellt, bei dem bei 870 °C unter Schutzgasatmosphäre mit metallischem Natrium eine Reduktion von Kaliumchlorid durchgeführt wird. Das entstehende gasförmige Kalium wird in einer Kühlfalle durch Kondensation niedergeschlagen.
- Na+KCl⇌K↑+NaCldisplaystyle mathrm Na+KClrightleftharpoons Kuparrow +NaCl
Durch Variation der Destillationsparameter sind auch handelsübliche Na-K-Legierungen zugänglich.
Im Labor ist elementares Kalium über die Reduktion des Chromats[13] oder Dichromats mittels Zirconium nach:
- 2K2CrO4+Zr⟶4K+Zr(CrO4)2displaystyle ce 2 K2CrO4 + Zr -> 4 K + Zr(CrO4)2
- 2K2Cr2O7+Zr⟶4K+Zr(Cr2O7)2displaystyle ce 2 K2Cr2O7 + Zr -> 4 K + Zr(Cr2O7)2
oder die thermische Zersetzung von Kaliumazid:
- 2KN3⟶2K+3N2displaystyle ce 2 KN3 -> 2 K + 3 N2
sowie eine anschließende Destillation im Hochvakuum erhältlich.[14]
Eigenschaften |

Kalium

Kalium in einer Ampulle unter Paraffinöl
Analog zu den anderen Alkalimetallen reagiert Kalium mit vielen anderen Elementen und Verbindungen oft sehr heftig, insbesondere mit Nichtmetallen, und kommt in der natürlichen Umwelt nur chemisch gebunden vor. Kalium hat eine stärkere Reaktivität als Natrium und reagiert heftig mit Wasser unter Bildung von Kaliumhydroxid und Freisetzung von Wasserstoff. Hochgeschwindigkeitsaufnahmen der Reaktion von Alkalimetallen mit Wasser legen eine Coulomb-Explosion nahe.[15] Aufgrund der stark exothermen Reaktion entzündet sich der Wasserstoff bei Luftzutritt. Hierbei kann es zu Verpuffungen und Explosionen kommen. In trockenem Sauerstoff verbrennt das Metall mit intensiver violetter Flamme zu Kaliumhyperoxid KO2 und Kaliumperoxid K2O2. An feuchter Luft reagiert es sehr rasch mit Wasser und Kohlenstoffdioxid zu Kaliumcarbonat unter Wasserstoffbildung. In flüssigem Ammoniak ist Kalium, wie alle Alkalimetalle, unter Bildung einer blauvioletten Lösung gut löslich. Mit den Halogenen Brom und Iod in flüssiger oder fester Form setzt sich Kalium explosionsartig zu den entsprechenden Halogeniden um.
Zur Entsorgung von Kalium wird meist das vorsichtige Einbringen kleiner Stücke des Metalls in einen großen Überschuss an tert-Butylalkohol empfohlen, mit dem es unter Bildung des Alkoholats und Wasserstoff reagiert. Da diese Reaktion recht langsam verläuft, kann es passieren, dass unbemerkt kleine, mit einer Kruste von Kalium-tert-butanolat umhüllte Kaliumreste übrigbleiben. Daher muss sorgfältig auf die Vollständigkeit der Reaktion geachtet werden. Alternativ kann man für kleine Kaliummengen auch 1-Butanol verwenden, das mit dem Kalium zwar schneller, aber dennoch kontrollierbar reagiert. Keinesfalls sollten „niedrigere“ Alkohole (Propanole, Ethanol oder Methanol) verwendet werden, da diese zu heftig mit Kalium reagieren und zudem leichter entzündlich sind.
An der Luft überzieht sich die silberweiß glänzende Schnittfläche des frischen Metalls innerhalb von Sekunden mit einer bläulich schimmernden Schicht aus Oxid und Hydroxid und ein wenig Carbonat. An der Luft stehengelassen reagiert es wie alle Alkalimetalle langsam vollständig zum Carbonat. Metallisches Kalium wird deshalb unter wasserfreien organischen Flüssigkeiten, wie z. B. Paraffinöl aufbewahrt. Im Gegensatz zu Natrium kann Kalium bei längerer Lagerung dennoch Krusten aus Oxiden, Peroxiden und Hydroxiden bilden, die das Metall in Form rötlich-gelber Schichten überziehen und die bei Berührung oder Druck explodieren können. Eine sichere Entsorgung ist dann nicht mehr möglich, hier bietet sich nur noch der Abbrand des kompletten Gebindes unter kontrollierten Bedingungen an.[16] Auch in Polyethenverpackungen eingeschweißtes Kalium kann sich mit einer explosiven Kruste überziehen, eine solche Verpackung ist also zur Lagerung nicht geeignet.[17]
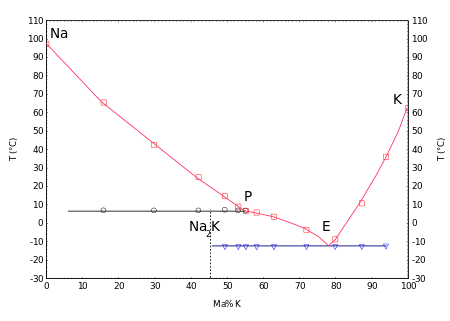
Mit Natrium werden in einem weiten Konzentrationsbereich bei Raumtemperatur flüssige Gemische gebildet, siehe: NaK (Legierung). Das Phasendiagramm zeigt eine bei 7 °C inkongruent schmelzende Verbindung Na2K und ein Eutektikum bei −12,6 °C mit einem Natriumgehalt von 23 %w.[18]
Verwendung |
Kalium ist in einigen schnellen Kernreaktoren in Form einer eutektischen Na-K-Legierung als Kühlflüssigkeit eingesetzt worden. Ansonsten hat metallisches Kalium nur geringe technische Bedeutung, da es durch das billigere Natrium ersetzt werden kann.
Im Forschungslabor wird Kalium gelegentlich zur Trocknung von Lösungsmitteln eingesetzt, besonders wenn der Siedepunkt des Lösungsmittels über dem Schmelzpunkt des Kaliums, aber unter dem Schmelzpunkt von Natrium liegt. Dann liegt das Kalium im siedenden Lösungsmittel geschmolzen vor und seine Oberfläche verkrustet nicht. Man benötigt somit deutlich weniger Alkalimetall und es kann fast völlig beim Trocknungsprozess verbraucht werden, so dass nur sehr kleine Reste entsorgt werden müssen.
Kalium entwickelt beim langen Stehenlassen auch unter Schutzflüssigkeit (Petroleum) Krusten von Peroxoverbindungen (K2O2 und KO2), die sehr brisant reagieren. Bereits durch geringen Druck, insbesondere beim Herausheben von Kaliumstücken mit einer Zange oder beim Versuch des Schneidens mit dem Messer, können diese Peroxoverbindungen Explosionen auslösen. Als Gegenmaßnahmen empfehlen sich entweder das Einschmelzen in Glasampullen oder ein Lagern unter Schutzflüssigkeit und Inertgas. Weiterhin dürfen halogenierte Lösemittel aufgrund der Explosionsgefahr nicht mit Kalium getrocknet werden. Ebenfalls gefährlich sind Reaktionen des Kaliums im Zusammenspiel von Lösemitteln, die leicht Sauerstoff abgeben können.
Weitere Verwendungen:
- Dotierung von Wolframdrähten zur Herstellung von Glühlampenwendeln
- Na-K-Wärmelegierung (siehe Natrium)
- In Form von Kaliumhyperoxid KO2 als Kaliumluftfilter (siehe Kali-Patronen) unter anderem auf U-Booten zur Atemluftregenerierung im Einsatz
Biologische Bedeutung |
Bedeutung als Düngemittel |
Wasserlösliche Kaliumsalze werden als Düngemittel verwendet, da Pflanzen die im Boden vorkommenden Kaliumsilicate schlecht aufschließen können.
Die Wirkung des essentiellen Makronährstoffes Kalium in den Pflanzen ist vielfältig. Im Xylem dient es als Osmotikum welches für den Aufbau des Wurzeldrucks entscheidend ist. Kalium in den Blattzellen erhöht den Turgor, was zu einer Zellstreckung und Blattflächenwachstum führt. Auch sorgt es über die Erhöhung des Turgors für eine Öffnung der Stomata, was die CO2-Aufnahme begünstigt und somit direkten Einfluss auf die Photosyntheseleistung hat. Ist Kalium in ausreichenden Mengen vorhanden, fördert es in einem ersten Schritt die Bildung von C3-Zuckern, die in weiteren von Kalium beeinflussten Stoffwechselprozessen zu Stärke, Zellulose, Lignin und Proteinen verarbeitet werden.
Pflanzen, die unter Kaliummangel leiden, weisen vornehmlich an den älteren Blättern Symptome auf. Kalium wird aus ihnen retransloziert und über das Phloem in junge Blätter transportiert.
Typische Symptome eines Kaliummangels sind Punkt-, Interkostal- und Blattrandchlorosen sowie Blattrandnekrosen. Auch kommt es zu einem gestauchten Habitus und gegebenenfalls zur Welketracht. Bei starker Sonneneinstrahlung kann es zur Photooxidation in den Blättern kommen.[19] Ein stärkerer Überschuss bewirkt Wurzelverbrennungen und Calcium- beziehungsweise Magnesium-Mangel.
Kalium ist der Gegenspieler von Calcium – beide Nährelemente müssen also in einem richtigen Verhältnis zueinander in der Pflanze und im Boden vorhanden sein.
Wichtige kaliumhaltige Düngemittel:
- Kornkali mit MgO
- Patentkali
- Kaliumsulfat
- Flory
- Nitrophoska
- Kaliphosphat
- Kalinitrat
Bedeutung für den menschlichen Körper |
Kalium ist ein für die Erhaltung des Lebens essenzieller Mineralstoff (Mengenelement). Als wichtigstes intrazelluläres (= innerhalb einer Zelle) Kation ist Kalium an den physiologischen Prozessen in jeder Zelle beteiligt:
Bioelektrizität der Zellmembranen, d. h. normale neuromuskuläre Reizbarkeit, Reizbildung und Reizleitung des Herzens[20][21]- Regulation des Zellwachstums[22][23]
- Beeinflussung von protektiven endothelialen Gefäßfunktionen[24][25]
- Aufrechterhaltung eines normalen Blutdrucks[26][27][28][29]
- Regulation des Säuren-Basen-Gleichgewichtes durch Beeinflussung der renalen Netto-Säureausscheidung[30][31][32][33][34][35][36]
- Beeinflussung der Freisetzung von Hormonen (z. B. Insulin aus den Beta-Zellen)
- Kohlenhydratverwertung und Eiweißsynthese
Empfohlene und tatsächliche Kaliumzufuhr |
Zur Aufrechterhaltung aller lebenswichtigen physiologischen Prozesse wird geraten, mindestens 2 g Kalium täglich zu sich zu nehmen. Das Food and Nutrition Board (FNB) der USA und Kanada erachtet allerdings unter präventiven Aspekten für alle Erwachsenen eine Einnahme von 4,7 g/Tag (120 mmol/Tag) als angemessen. Diese Kaliummenge (aus der Nahrung) ist aufgrund neuer Erkenntnisse erforderlich, um chronischen Erkrankungen wie erhöhtem Blutdruck, Kochsalzsensitivität, Nierensteinen, Verlust an Knochenmasse oder Schlaganfällen vorzubeugen bzw. sie zu vermindern oder zu verzögern.[37][38][39][40][41][42][43][44][45]
Laut der Nationalen Verzehrsstudie II (NVS II) liegt die Kaliumzufuhr in Deutschland im Median bei 3,1 g/Tag (Frauen) bzw. 3,6 g/Tag (Männer). Von 75 % der Männer und 90 % der Frauen wird die vom FNB empfohlene Zufuhr von 4,7 g Kalium pro Tag nicht erreicht.[46]
Bedeutung des Natrium/Kalium-Verhältnisses |
Im Körper spielt Kalium eine herausragende Rolle bei der Regulation des Membranpotentials. Die intrazelluläre Kaliumkonzentration liegt bei ungefähr 150 mmol/l, extrazellulär finden sich 4 mmol/l. Die Konzentration an Natrium liegt intrazellulär bei rund 10 mmol/l, extrazellulär bei 140 mmol/l. Diese Konzentrationsunterschiede werden durch die Na/K-ATPase aufrechterhalten und sind für die Funktion der Zelle lebenswichtig. Ein dauerhaftes Verschieben dieser zellulären Konzentrationen kann bei erhöhter K+-Konzentration (Hyperkaliämie), das heißt K+ >>4,5 mmol/l, zu Herzstillstand in Systole führen, bei Hypokaliämie (K+ <3,5 mmol/l) zur Abnahme der Kontraktionsfähigkeit der Muskeln, erhöhter Erregung, Störung der Erregungsleitung, Extrasystolen des Herzens. K+ ist (neben Na+) entscheidend für den osmotischen Druck der Zellen, das heißt für den Wassergehalt der Zelle. Eine zu geringe K+-Konzentration im Blut führt zu Herzstillstand in Diastole. Der Normbereich im Serum liegt bei 3,6–4,5 mmol/l, im Harn bei 26–123 mmol/l. Das heißt, es wird ständig K+ verloren, das mit der Nahrung ersetzt werden muss.
Das ist insbesondere in der heutigen Zeit ein Problem, da die westliche Ernährungsweise von der Zufuhr tierischer Lebensmittel geprägt ist. Die Zufuhr kaliumreicher, pflanzlicher Lebensmittel ist im Vergleich zu früher hingegen deutlich vermindert. Vor der Entwicklung der Landwirtschaft lag die Kaliumzufuhr bei 10,5 g/Tag,[47] im Vergleich zu den durchschnittlich 3,4 g/Tag laut NVS II.[46] Demgegenüber steht die ins Gegenteil verschobene Natriumzufuhr: Diese lag früher bei lediglich 0,8 g/Tag[47] und ist durch unsere salzreiche Ernährung auf durchschnittlich 3,1 g/Tag (Frauen) bzw. 4,3 g/Tag (Männer) angestiegen.[48] Das hat Auswirkungen auf das natürliche Verhältnis von Kalium zu Natrium im menschlichen Körper.
Kalium ist der natürliche Gegenspieler von Natrium, und ein ausgewogenes Verhältnis der beiden Mineralien ist für die Regulation physiologischer Prozesse besonders wichtig. Eine exzessive Natriumzufuhr kann zur Kaliumverarmung führen. Umgekehrt hat Kalium einen natriuretischen Effekt. Insofern ist das Na/K-Verhältnis in der Nahrung entscheidender als die Konzentration der einzelnen Kationen für sich allein. Die WHO empfiehlt ein molares Verhältnis der beiden Mineralstoffe von 1:1.[49] Diesem Verhältnis werden die WHO-Empfehlungen von weniger als 2 g Natrium pro Tag[50] und mindestens 3,5 g Kalium pro Tag gerecht.[49]
Physiologische Bedeutung |
Neben Natrium hat Kalium große Bedeutung für die Regulation des Blutdrucks.[51][52]Epidemiologische Studien belegen, dass eine erhöhte Kaliumaufnahme mit einer Blutdrucksenkung einhergeht und das Risiko für Schlaganfälle reduziert. Die blutdrucksenkende Wirkung von Kalium wurde auch in Supplementierungsversuchen nachgewiesen.[53][54][55][45][56][57][58][59][60]
Eine blutdrucksenkende Wirkung konnte auch allein durch die so genannte DASH (Dietary Approaches to Stop Hypertension) Diät (reich an Vollkorn-Getreideprodukten, Obst, Gemüse, Geflügel, Fisch und Nüssen) erreicht werden. Diese Diät enthält im Gegensatz zur üblichen Kost weniger Kochsalz und gesättigte Fette, relativ viel Kalium, aber auch mehr an anderen Nährstoffen wie Magnesium und Calcium, die auch für eine blutdrucksenkende Wirkung mit verantwortlich gemacht werden.[61][62][63] Aus diesem Grunde sollte eine obst- und gemüsereiche Kost (reich an Kalium) in Kombination mit einer moderaten Senkung der Natriumzufuhr empfohlen werden, da sich ein Verhältnis Natrium zu Kalium von 1 oder weniger günstig auf den Blutdruck auswirkt. Eine Angleichung der Kaliumzufuhr an eine hohe Natriumaufnahme ist nicht sinnvoll.[64] Auch die Europäische Behörde für Lebensmittelsicherheit (EFSA) bestätigt die blutdruckerhöhende Wirkung von Natrium.[65]
Kalium hat außerdem einen positiven Einfluss auf den Knochenstoffwechsel, da eine höhere Kaliumzufuhr eine erhöhte Calciumausscheidung verhindert, die durch eine hohe Kochsalzzufuhr hervorgerufen wird. Kalium fördert somit die renale Calciumretention in der Niere und verhindert den Calciumabbau aus den Knochen.[66][67][68] In diesem Zusammenhang sind auch der Einfluss des Begleitanions, der Zusammensetzung der Nahrung und des Lebensalters auf den Säuren-Basen-Status zu beachten.[69][70][71][72][73][74][75] Für Kaliumcitrat ist in klinischen Studien nachgewiesen, dass es dem Calciumverlust über die Niere und dem Calciumabbau aus den Knochen entgegenwirkt.[76][77][78] So zeigte eine prospektive kontrollierte Interventionsstudie bei 161 postmenopausalen Frauen mit Osteopenie, dass die partielle Neutralisierung einer diätinduzierten Säurebelastung (mittels 30 mmol Kaliumcitrat pro Tag, entspricht 1,173 g Kalium) über einen Zeitraum von zwölf Monaten die Knochendichte signifikant erhöht und die Knochenstruktur deutlich verbessert. Kaliumcitrat wirkte dabei genauso effektiv wie Raloxifen, ein Östrogen-Rezeptor-Modulator, der bei der Behandlung und Prävention von Osteoporose bei postmenopausalen Frauen eingesetzt wird.[76]
Kalium gehört zu den wichtigsten Elektrolyten der Körperflüssigkeit und ist für die Steuerung der Muskeltätigkeit mitverantwortlich. Bei Leistungssportlern kann es durch übermäßiges Ausschwitzen von Kalium zu Krämpfen und Erschöpfungszuständen kommen.
Kaliumreiche Nahrungsmittel wirken harntreibend/entwässernd. Bei dialysepflichtigen Patienten mit eingeschränkter Nierenfunktion ist es wichtig, dass sie stark kaliumhaltige Lebensmittel meiden, da es bei Hyperkaliämie zu lebensbedrohlichen Zuständen kommen kann.
Die in den Vereinigten Staaten zu Hinrichtungen verwendete Giftspritze enthält unter anderem Kaliumchlorid, welches zu einer Lähmung der Herzmuskulatur und damit zum Tode führt.
Für weitere Informationen zu körperlichen Auswirkungen von Kalium
Kaliumgehalte in Lebensmitteln |
Kaliumreiche Lebensmittel sind unter anderem Pilze, Bananen, Datteln, Rosinen, Bohnen, Chili, Käse, Spinat und Kartoffeln, in denen es in Mengen von 0,2 bis 1,0 g Kalium/100 g Lebensmittel vorkommt.
Kaliumgehalte in kaliumreichen Lebensmitteln in mg pro 100 g; aus der USDA National Nutrient Database (2011)[79]
| Lebensmittel 100 g | Kalium |
|---|---|
Sojabohne (getrocknet) | 000000000001800.00000000001.800 mg |
Aprikosen (getrocknet)[80] | 000000000001370.00000000001.370 mg |
Weizenkleie | 000000000001350.00000000001.350 mg |
Pistazie | 000000000001020.00000000001.020 mg |
Tomatenmark | 000000000001014.00000000001.014 mg |
Rote-Bete-Blätter (gekocht) | 000000000000909.0000000000909 mg |
Linsen | 000000000000840.0000000000840 mg |
Rosinen | 000000000000749.0000000000749 mg |
Mandeln | 000000000000705.0000000000705 mg |
Orangensaft | 000000000000674.0000000000674 mg |
Erdnuss | 000000000000658.0000000000658 mg |
Dattel (Deglet Nour) | 000000000000656.0000000000656 mg |
Sojamilch | 000000000000638.0000000000638 mg |
Esskastanien (geröstet) | 000000000000592.0000000000592 mg |
Buchweizenmehl (Vollkorn) | 000000000000577.0000000000577 mg |
Cashew | 000000000000565.0000000000565 mg |
Pommes frites (Pflanzenöl) | 000000000000550.0000000000550 mg |
Kartoffeln (ungeschält, gebacken) | 000000000000535.0000000000535 mg |
Sojabohnen (gekocht) | 000000000000515.0000000000515 mg |
Avocado | 000000000000485.0000000000485 mg |
Grapefruitsaft (weiß) | 000000000000484.0000000000484 mg |
Spinat (gekocht) | 000000000000466.0000000000466 mg |
Kochbananen (gekocht) | 000000000000464.0000000000464 mg |
weiße Bohnen | 000000000000454.0000000000454 mg |
Tomatenpüree | 000000000000439.0000000000439 mg |
Kidneybohnen (gekocht) | 000000000000402.0000000000402 mg |
Da die in Lebensmitteln enthaltenen Kaliumsalze sehr gut wasserlöslich sind, lässt sich der Kaliumgehalt von Lebensmitteln durch das sog. Wässern (in Wasser einlegen für ca. drei bis fünf Stunden) merklich senken. Dies ist besonders wichtig für Personen mit Nieren- und Stoffwechselstörungen.[81]
Radioaktivität |

Zerfallsdiagramm von 40K
Natürliches Kalium besteht zu 0,0117 Prozent aus dem radioaktiven Isotop 40K und hat daher eine spezifische Aktivität von 30,346 Becquerel pro Gramm. Mit 0,17 mSv pro Jahr werden fast 10 Prozent der natürlichen radioaktiven Belastung in Deutschland (durchschnittlich 2,1 mSv pro Jahr) durch körpereigenes Kalium verursacht.[82]
Der Zerfall von 40K zu 40Ar und 40Ca kann auch zur Altersbestimmung mittels Kalium-Argon-Datierung verwendet werden und ist eine wesentliche Quelle für Argon in der Erdatmosphäre.
Kaliumnachweis |
Neben dem spektroskopischen Nachweis kann man in Wasser gelöste Kaliumionen potentiometrisch mit einer auf K+ spezialisierten ionenselektiven Elektrode nachweisen und bestimmen. Dabei nutzen die meisten Kaliumelektroden die spezifische Komplexierung von Kalium durch Valinomycin C54H90N6O18, welches in einer Konzentration von etwa 0,7 % in eine Kunststoffmembran eingebettet ist.
Ein qualitativer Kaliumnachweis ist mittels Perchlorsäure möglich. Es bildet sich das in der Kälte in Wasser schwer lösliche Kaliumperchlorat als weißer Niederschlag. Allerdings bilden auch andere Kationen wie Rubidium, Caesium und Ammonium weiße, in der Kälte schwer lösliche Niederschläge.
Quantitativ lässt sich Kalium mit Hilfe der Gravimetrie bestimmen. Hierbei wird Kalium als Kaliumtetraphenylborat (K[B(C6H5)4]) durch Versetzen der Lösung mit Kalignost gefällt und der erhaltene Niederschlag ausgewogen.
Weitere Nachweise sind als Fällungen von Kaliumhexanitrocobaltat(III), Kaliumhydrogentartrat (KA=3,80 · 10−4) und Kaliumhexachloroplatinat(IV) möglich.
In der Routineanalytik (Klinische Chemie (Blut), Umweltchemie, Wasserchemie) wird Kalium bis in den Spurenbereich mit der Flammenphotometrie quantitativ bestimmt. Als Bestimmungsgrenze wird hier 100 µg/l genannt.[83] In der Atomabsorptionsspektrometrie ist mit der Flammentechnik noch 1 µg/l nachweisbar, mit der Graphitrohrtechnik 0,004 µg/l.[83]
Verbindungen |
→ Kategorie:Kaliumverbindung
In seinen Verbindungen kommt Kalium nur als einwertiges Kation vor:
Oxide, Hydroxide, Carbonate |
- Kaliumoxid
- Kaliumhydroxid
- Kaliumhyperoxid
Kaliumcarbonat (Pottasche)- Kaliumhydrogencarbonat
Halogenide |
- Kaliumfluorid
- Kaliumchlorid
- Kaliumbromid
- Kaliumiodid
Salze von Sauerstoffsäuren |
- Kaliumchlorat
- Kaliumbromat
- Kaliumiodat
- Kaliumperchlorat
- Kaliumnitrat
- Kaliumsulfat
- Kaliumthiocyanat
- Kaliumphosphat
- Kaliumdihydrogenphosphat
Weitere Verbindungen |
- Kaliumcyanid
- Kaliumhydrid
Kaliumhydrogentartrat (Weinstein)
Kalium-Natrium-Tartrat (Seignette-Salz)
- Kaliumchromat
- Kaliumdichromat
- Kaliumpermanganat
- Kaliumhexacyanoferrat(II)
- Kaliumhexacyanoferrat(III)
- Kaliumniobat
Einzelnachweise |
↑ ab Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Kalium) entnommen.
↑ CIAAW, Standard Atomic Weights Revised 2013.
↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Festkörper. (= Lehrbuch der Experimentalphysik. Band 6). 2. Auflage. De Gruyter, Berlin 2005, ISBN 3-11-017485-5, S. 361.
↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 97.
↑ Robert C. Weast u. a. (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
↑ ab Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Electrochemical Series, S. 8-22.
↑ ab Eintrag zu Kalium in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. August 2016 (JavaScript erforderlich)
↑ Eintrag zu Potassium im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
↑ New Technique Finds Gaseous Metals in Exoplanet Atmospheres wired.com, 31. August 2010.
↑ Astronomers Find Potassium in Giant Planet's Atmosphere sciencedaily.com, 1. September 2010, (abgerufen am 20. September 2010).
↑ A. E. van Arkel, P. Aßmann, G. Borelius, G. Chaudron, E. J. Daniels, R. Gadeau, W. Geibel, W. Graßmann, C. R. Hayward, G. Jantsch, W. Kroll, K. Lins: Reine Metalle: Herstellung · Eigenschaften · Verwendung, Herausgeber A. E. van Arkel, Verlag Springer-Verlag, 2013, ISBN 9783642996955.
↑ Georg Brauer: Freie Alkalimetalle. In: Handbuch der Präparativen Anorganischen Chemie. Ferdinand Enke Verlag, Stuttgart 1954, S. 724 ff.
↑ P. E. Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth: Coulomb explosion during the early stages of the reaction of alkali metals with water. In: Nature chemistry. Band 7, Nummer 3, März 2015, S. 250–254, doi:10.1038/nchem.2161, PMID 25698335.
↑ Freie Universität Berlin, Institut für Chemie und Biochemie Entsorgung von Kalium (Memento vom 13. Dezember 2013 im Webarchiv archive.is)
↑ J. Evers, T.M. Klapötke, G. Oehlinger: Dangerous Potassium Hydroxide Monohydrate Crust. In: Chemical & Engineering News, 80(37), S. 2, 4.
↑ G.L.C.M. van Rossen, H. van Bleiswijk: Über das Zustandsdiagramm der Kalium-Natriumlegierungen. In: Z. anorg. allg. Chem., 1912, 74, S. 152–156. doi:10.1002/zaac.19120740115.
↑ Konrad Mengel: Ernährung und Stoffwechsel der Pflanze. 7. Auflage. Fischer, Jena 1991, ISBN 3-334-00310-8, S. 335–346.
↑ Shieh u. a.: Potassium channels: molecular defects, diseases, and therapeutic opportunities. In: Pharmacol Rev. 52(4), Dec 2000, S. 557–594, PMID 11121510.
↑ Tamargo u. a.: Pharmacology of cardiac potassium channels. In: Cardiovasc Res. 62(1), 1 Apr 2004, S. 9–33, PMID 15023549.
↑ Niemeyer u. a.: Modulation of the two-pore domain acid-sensitive K+ channel TASK-2 (KCNK5) by changes in cell volume. In: J Biol Chem. 276(46), 16 Nov 2001, S. 43166–43174, PMID 11560934.
↑ Shen u. a.: The KCl cotransporter isoform KCC3 can play an important role in cell growth regulation. In: Proc Natl Acad Sci U S A. 98(25), 4 Dec 2001, S. 14714–14719, PMID 11724933.
↑ Young u. a.: Determinants of cardiac fibrosis in experimental hypermineralocorticoid states In: Am J Physiol-Endocrinol Metab. 269(4 Pt 1), Oct 1995, S. E657–E662, PMID 7485478.
↑ Young & Ma: Vascular protective effects of potassium. In: Semin Nephrol. 19, 1999, S. 477–486, PMID 10511387.
↑ Krishna: Effect of potassium intake on blood pressure. In: J Am Soc Nephrol. 1(1), Jul 1990, S. 43–52, PMID 2104250.
↑ Suter: Potassium and hypertension. In: Nutr Rev. 56(5 Pt 1), May 1998, S. 151–153, PMID 9624886.
↑ Young u. a.: Potassium's cardiovascular protective mechanisms. In: Am J Physiol-Regul Integr Comp Physiol. 268(4 Pt 2), Apr 1995, S. R825–R837, PMID 7733391.
↑ Tannen: The influence of potassium on blood pressure. In: Kidney Int Suppl. 22, 1987, S. S242–S248, PMID 3323616.
↑ Frassetto u. a.: Diet, evolution and aging – the pathophysiologic effects of the post-agricultural inversion of the potassium-to-sodium and base-to-chloride ratios in the human diet. In: Eur J Nutr. 40(5), Oct 2001, S. 200–213, PMID 11842945.
↑ Frassetto u. a.: Estimation of net endogenous noncarbonic acid production in humans from diet potassium and protein contents. In: Am J Clin Nutr. 68(3), Sep 1998, S. 576–583, PMID 9734733.
↑ Frassetto u. a.: Potassium bicarbonate reduces urinary nitrogen excretion in postmenopausal women. In: J Clin Endocrinol Metab. 82(1), Jan 1997, S. 254–259, PMID 8989270.
↑ Manz u. a.: Factors affecting renal hydrogen ion excretion capacity in healthy children. In: Pediatr Nephrol. 16(5), May 2001, S. 443–445, PMID 11405120.
↑ Remer u. a.: Dietary potential renal acid load and renal net acid excretion in healthy, free-living children and adolescents. In: Am J Clin Nutr. 77(5), May 2003, S. 1255–1260, PMID 12716680.
↑ Remer: Influence of diet on acid-base balance. In: Semin Dial. 13(4), Jul-Aug 2000, S. 221–226, PMID 10923348.
↑ Tannen: Effect of potassium on renal acidification and acid-base homeostasis. In: Semin Nephrol. 7(3), Sep 1987, S. 263–273, PMID 2825318.
↑ Europäische Behörde für Lebensmittelsicherheit: EFSA Journal. 8(2), 2010, S. 1469.
↑ Bundesinstitut für Risikobewertung: Verwendung von Mineralstoffen in Lebensmitteln: Toxikologische und physiologische Aspekte.
↑ Curhan u. a.: Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women. In: Ann Intern Med. 126(7), 1 Apr 1997, S. 497–504. PMID 9092314.
↑ Hirvonen u. a.: Nutrient intake and use of beverages and the risk of kidney stones among male smokers. In: Am J Epidemiol. 150(2), 15 Jul 1999, S. 187–194. PMID 10412964.
↑ Keßler & Hesse: Cross-over study of the influence of bicarbonate-rich mineral water on urinary composition in comparison with sodium potassium citrate in healthy male subjects. In: Br J Nutr. 84(6), Dec 2000, S. 865–871. PMID 11177203.
↑ Macdonald u. a.: Nutritional associations with bone loss during the menopausal transition: evidence of a beneficial effect of calcium, alcohol, and fruit and vegetable nutrients and of a detrimental effect of fatty acids. In: Am J Clin Nutr. 79(1), Jan 2004, S. 155–165. PMID 14684412.
↑ Morris u. a.: Differing effects of supplemental KCl and KHCO3: pathophysiological and clinical implications. In: Semin Nephrol. 19(5), Sep 1999, S. 487–493. PMID 10511388.
↑ Sellmeyer u. a.: Potassium citrate prevents increased urine calcium excretion and bone resorption induced by a high sodium chloride diet. In: J Clin Endocrinol Metab. 87(5), May 2002, S. 2008–2012. PMID 11994333.
↑ ab Suter: The effects of potassium, magnesium, calcium, and fiber on risk of stroke. In: Nutr Rev. 57(3), Mar 1999, S. 84–88. PMID 10101922.
↑ ab Max Rubner-Institut, Bundesforschungsinstitut für Ernährung und Lebensmittel (2008) Nationale Verzehrsstudie II. Ergebnisbericht Teil 2. Die bundesweite Befragung zur Ernährung von Jugendlichen und Erwachsenen.@1@2Vorlage:Toter Link/www.mri.bund.de (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 3,3 MB).
Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 3,3 MB).
↑ ab Eaton u. a.: Paleolithic nutrition revisited: a twelve-year retrospective on its nature and implications. In: Eur J Clin Nutr. 51(4), 1997, S. 207–216. PMID 9104571.
↑ P. Elliott, I. Brown: Sodium intakes around the world. Background document prepared for the Forum and Technical meeting on Reducing Salt Intake in Populations (Paris 5-7th October 2006). (PDF; 2,2 MB).
↑ ab World Health Organization: Guideline: Potassium intake for adults and children. Geneva 2012. (PDF; 564 KB).
↑ World Health Organization: Global Strategy on Diet, Physical Activity and Health. Population sodium reduction strategies. Abgerufen am 13. Dezember 2013.
↑ Suter u. a.: Nutritional factors in the control of blood pressure and hypertension. In: Nutr Clin Care. 5(1), Jan-Feb 2002, S. 9–19, PMID 12134718.
↑ Tobian: Dietary sodium chloride and potassium have effects on the pathophysiology of hypertension in humans and animals. In: Am J Clin Nutr. 65(2 Suppl), Feb 1997, S. 606S–611S, PMID 9022555.
↑ Bazzano u. a.: Dietary potassium intake and risk of stroke in US men and women: National Health and Nutrition Examination Survey I epidemiologic follow-up study. In: Stroke. 32(7), Jul 2001, S. 1473–1480, PMID 11441188.
↑ Ascherio u. a.: Intake of potassium, magnesium, calcium, and fiber and risk of stroke among US men. In: Circulation. 98(12), 22 Sep 1998, S. 1198–1204, PMID 9743511.
↑ Barri & Wingo: The effects of potassium depletion and supplementation on blood pressure: a clinical review. In: Am J Med Sci. 314(1), Jul 1997, S. 37–40, PMID 9216439.
↑ Geleijnse u. a.: Electrolytes are associated with blood pressure at old age: the Rotterdam Study. In: J Hum Hypertens. 11(7), Jul 1997, S. 421–423, PMID 9283057.
↑ Khaw & Barrett-Connor: Dietary potassium and blood pressure in a population. In: Am J Clin Nutr. 39(6), Jun 1984, S. 963–968, PMID 6720624.
↑ Khaw & Barrett-Connor: Dietary fiber and reduced ischemic heart disease mortality rates in men and women: a 12-year prospective study. In: Am J Epidemiol. 126(6), Dec 1987, S. 1093–1102, PMID 2825519.
↑ Siani u. a.: Controlled trial of long term oral potassium supplements in patients with mild hypertension. In: Br Med J (Clin Res Ed). 294(6585), 6 Jun 1987, S. 1453–1456, PMID 3300841.
↑ Svetkey u. a.: Double-blind, placebo-controlled trial of potassium chloride in the treatment of mild hypertension. In: Hypertension. 9(5), May 1987, S. 444–450, PMID 3570421.
↑ Sacks u. a.: Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. In: N Engl J Med. 344(1), 4 Jan 2001, S. 3–10, PMID 11136953.
↑ Vollmer u. a.: New insights into the effects on blood pressure of diets low in salt and high in fruits and vegetables and low-fat dairy products. In: Curr Control Trials Cardiovasc Med. 2(2), 2001, S. 71–74, PMID 11806776.
↑ Zemel: Dietary pattern and hypertension: the DASH study. Dietary Approaches to Stop Hypertension. In: Nutr Rev. 55(8), Aug 1997, S. 303–305, PMID 9287480.
↑ Bundesinstitut für Risikobewertung: Verwendung von Mineralstoffen in Lebensmitteln.
↑ Europäische Behörde für Lebensmittelsicherheit: EFSA Journal. 8(2), 2010, S. 1469.
↑ Harrington, Cashman: High salt intake appears to increase bone resorption in postmenopausal women but high potassium intake ameliorates this adverse effect. In: Nutr Rev. 61(5 Pt 1), May 2003, S. 179–183, PMID 12822707.
↑ Lemann u. a.: Potassium administration reduces and potassium deprivation increases urinary calcium excretion in healthy adults. In: Kidney Int. 39(5), May 1991, S. 973–983, PMID 1648646.
↑ New u. a.: Lower estimates of net endogenous non-carbonic acid production are positively associated with indexes of bone health in premenopausal and perimenopausal women. In: Am J Clin Nutr. 79(1), Jan 2004, S. 131–138. PMID 14684409.
↑ Barzel: The skeleton as an ion exchange system: implications for the role of acid-base imbalance in the genesis of osteoporosis. In: J Bone Miner Res. 10(10), Oct 1995, S. 1431–1436, PMID 8686497.
↑ Frassetto u. a.: Effect of age on blood acid-base composition in adult humans: role of age-related renal functional decline. In: Am J Physiol. 271(6 Pt 2), Dec 1996, S. F1114–F1122, PMID 8997384.
↑ Lemann: Relationship between urinary calcium and net acid excretion as determined by dietary protein and potassium: a review. In: Nephron. 81 Suppl 1, 1999, S. 18–25, PMID 9873210.
↑ Massey: Dietary animal and plant protein and human bone health: a whole foods approach. In: J Nutr. 133(3), Mar 2003, S. 862S-865S, PMID 12612170.
↑ Morris u. a.: Differing effects of supplemental KCl and KHCO3: pathophysiological and clinical implications. In: Semin Nephrol. 19(5), Sep 1999, S. 487–493, PMID 10511388.
↑ Remer und Manz: Don’t forget the acid base status when studying metabolic and clinical effects of dietary potassium depletion. In: J Clin Endocrinol Metab. 86(12), Dec 2001, S. 5996–5997, PMID 11739479.
↑ Remer: Influence of diet on acid-base balance. In: Semin Dial. 13(4), Jul-Aug 2000, S. 221–226, PMID 10923348.
↑ ab S. Jehle u. a.: Partial neutralization of the acidogenic western diet with potassium citrate increases bone mass in postmenopausal women with osteopenia. In: J Am Soc Nephrol. 17, 2006, S. 3213–3222, PMID 17035614.
↑ M. Marangella u. a.: Effects of potassium citrate supplementation on bone metabolism. In: Calcif Tissue Int. 74, 2004, S. 330–335, PMID 15255069.
↑ D. E. Sellmeyer u. a.: Potassium citrate prevents increased urine calcium excretion and bone resorption induced by a high sodium chloride diet. In: J Clin Endocrinol Metab. 87, 2002, S. 2008–2012, PMID 11994333.
↑ USDA National Nutrient Database for Standard Reference, Release 24 Content of Selected Foods per Common Measure, Potassium, K (mg) sorted by nutrient content (Memento vom 5. April 2013 im Internet Archive) (PDF; 150 kB).
↑ Aprikose getrocknet. Website des Deutschen Ernährungsberatungs- und Informationsnetzes. Abgerufen am 21. Oktober 2012.
↑ Kaliumarme Ernährung – Praxistipps.
↑ Bundesamt für Strahlenschutz: Welche Radionuklide kommen in Nahrungsmitteln vor? abgerufen am 19. August 2014.
↑ ab Karl Cammann (Hrsg.): Instrumentelle analytische Chemie. Spektrum, Heidelberg 2001, ISBN 3-8274-0057-0, S. 4–60.
Weblinks |
.mw-parser-output div.NavFrameborder:1px solid #A2A9B1;clear:both;font-size:95%;margin-top:1.5em;min-height:0;padding:2px;text-align:center.mw-parser-output div.NavPicfloat:left;padding:2px.mw-parser-output div.NavHeadbackground-color:#EAECF0;font-weight:bold.mw-parser-output div.NavFrame:afterclear:both;content:"";display:block.mw-parser-output div.NavFrame+div.NavFrame,.mw-parser-output div.NavFrame+link+div.NavFramemargin-top:-1px.mw-parser-output .NavTogglefloat:right;font-size:x-small





