Schlafapnoe-Syndrom
| Klassifikation nach ICD-10 | ||
|---|---|---|
| G47.3 | Schlafapnoe | |
| G47.30 | Zentrales Schlafapnoe-Syndrom | |
| G47.31 | Obstruktives Schlafapnoe-Syndrom | |
| G47.38 | Sonstige Schlafapnoe | |
| G47.39 | Schlafapnoe, nicht näher bezeichnet | |
ICD-10 online (WHO-Version 2016) | ||
Das Schlafapnoe-Syndrom (SAS), kurz auch Schlafapnoe, ist ein Beschwerdebild, das durch periodische Atemstörungen (Atemstillstände (Apnoen) und/oder Minderbelüftung der Lunge (alveoläre Hypoventilation))[1] während des Schlafs verursacht wird. Es ist gekennzeichnet durch eine ausgeprägte Tagesmüdigkeit bis hin zum Einschlafzwang (Sekundenschlaf) sowie einer Reihe weiterer Symptome und Folgeerkrankungen.
Die vom Duden vorgeschlagene Aussprache ist dreisilbig „A-pno-e“ ([.mw-parser-output .IPA atext-decoration:noneaˈpnoːə]) (zu griechisch ἄπνοια apnoia „Nicht-Atmung“), während viele Laien wie auch Ärzte den Begriff zu „Apnö“ ([apˈnøː]) eindeutschen.
Die Atemstillstände führen zu einer verringerten Sauerstoffversorgung bei gleichzeitigem Anstieg des Kohlendioxidgehalts des Blutes und in deren Folge zu wiederholten Aufweckreaktionen (Alarmreaktion des Körpers). Die meisten Aufweckreaktionen führen aber nicht zum bewussten Aufwachen, sondern lediglich zu erhöhten Körperfunktionen, beispielsweise zu beschleunigtem Puls und der wiederholten Ausschüttung von Stresshormonen welche als ein körpereigenes Notfall-Überlebensprogramm zu werten sind. Hierdurch wird auch die normale Schlafphasenabfolge betroffen, so dass neben den somatischen Stressoren auch die Erholungs- und Regenerationsfunktion des Nachtschlafes teils erheblich gemindert wird. Da diese Reaktionen noch im Schlafzustand ablaufen, werden sie von den Betroffenen meist nicht bewusst wahrgenommen. Die Folge der Schlafapnoe ist eine chronische körperliche Belastung und nicht erholsamer Schlaf, was meistens zu der typischen, ausgeprägten Tagesmüdigkeit mit ihren weiteren Risiken führt.
In der Schlafmedizin zählen die verschiedenen Formen des Schlafapnoe-Syndroms nach dem Klassifikationssystem für Schlafstörungen International Classification of Sleep Disorders (ICSD) zu den „Schlafbezogenen Atmungsstörungen“.[2]
Die Prävalenz (Häufigkeit) des Schlafapnoe-Syndroms mit einem Apnoe-Hypopnoe-Index (AHI) von mehr als 15 beträgt nach neuen Studien 9 % bei Männern und 4 % bei Frauen.
Inhaltsverzeichnis
1 Formen und Ursachen
1.1 Schlafapnoe bei Kindern
2 Symptome
3 Folgen
4 Diagnose
5 Behandlung
5.1 Konservative Therapie
5.1.1 Unterkieferprotrusionsschiene
5.2 Operative Therapie
5.3 Alternative Therapien
6 Ausmusterung bei der Bundeswehr
7 Siehe auch
8 Literatur
9 Weblinks
10 Einzelnachweise
Formen und Ursachen |
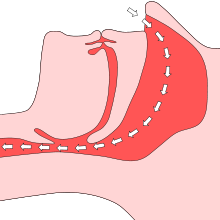
Freie Atemwege

Durch den Sog der Luft verschlossene Atmung
Die Atmung ist normalerweise ein unwillkürlicher Vorgang. Der Atemreiz wird nicht – wie vielfach angenommen – durch einen sinkenden Sauerstoffgehalt (O2) des Blutes oder der Gewebe ausgelöst, sondern ein steigender Kohlendioxidgehalt (CO2) des Blutes ist der stärkste Atemstimulus. Fällt der Partialdruck des Sauerstoffs unter eine individuelle Grenze, wird der Mensch ohnmächtig.[3] Während eines nur vorübergehenden Atemstillstands, einer Apnoe, steigt der CO2-Partialdruck im Blut deutlich an, so dass vor dem Eintreten einer Ohnmacht eine sog. Weckreaktion ausgelöst wird.
Man unterscheidet obstruktive und zentrale Apnoen. Kommen bei einem Patienten beide Formen vor, spricht man von gemischten Apnoesyndromen.
Die weitaus häufigste, bei etwa 5–10 % der Bevölkerung vorkommende Form ist das obstruktive Schlafapnoe-Syndrom (OSAS). Die direkte Ursache des OSAS ist eine starke Entspannung der ringförmigen Muskulatur um die oberen Atemwege im Schlaf. Dadurch sind der Nasen- bzw. der Mundrachen nicht mehr in der Lage, dem beim Einatmen in Lunge und Bronchien entstehenden Unterdruck genug Widerstand entgegenzusetzen. Der obere Teil der Atemwege fällt zusammen und es kommt zu einer Behinderung (Obstruktion) ebendieser. Krankhafte Atemstillstände dauern länger als zehn Sekunden, wodurch die arterielle Sauerstoffsättigung bzw. der Sauerstoffgehalt des Blutes abfällt (Hypoxämie). Dies führt erstens zu einer Mangelversorgung der Gewebe im Körper und im Gehirn und zweitens zu einem erhöhten CO2-Spiegel im Blut. In Folge der frustranen Einatmungsbewegung (Müller-Manöver) und des ansteigenden CO2-Spiegels kommt es zu einer Weckreaktion des Körpers („micro-arousal“), aufgrund derer die Atmung dann wieder einsetzt. Meist erinnert der Patient sich nicht an diese Reaktion. Die physiologische Struktur des Schlafs wird zerstört und die Erholungsfunktion behindert. Fällt der obere Teil der Atemwege nur teilweise zusammen, kommt es zu einer kurzzeitigen Reduzierung des Atemvolumens, den so genannten Hypopnoen. Auch dabei sinkt letztlich der Sauerstoffgehalt im Blut, aber nicht so stark wie bei Apnoen. Die Anzahl der Apnoen und Hypopnoen pro Stunde gibt der so genannte AHI (Apnoe-Hypopnoe-Index) wieder. Beim Zusammenfallen der oberen Atemwege entstehen bei vielen Betroffenen Schnarchgeräusche, sodass viele der OSAS-Patienten starke Schnarcher sind. Bei Schnarchern mit starker Tagesmüdigkeit besteht daher der dringende Verdacht auf OSAS. Schnarchen (Rhonchopathie) allein und auch gelegentliche, kurze Atmungsaussetzer sind nicht gesundheitsschädlich. In Deutschland sind 1–2 % der Frauen und 2–4 % der Männer im mittleren Lebensalter vom OSAS betroffen. Häufig löst die OSAS auch zentrale Atemaussetzer aus, sodass auch die gemischte Form sehr häufig ist.
Das Upper Airway Resistance Syndrom (UARS) ist eine Unterform der schlafbezogenen Atmungsstörungen, bei der der Muskeltonus im Bereich der oberen Atemwege noch ausreichend hoch ist, um einen Teil des Lumens der Atemwege offen zu halten. Es kommt aufgrund einer vermehrten Atemanstrengung zu vermehrten Weckreaktionen auch ohne signifikanten Sauerstoff-Abfall ebenfalls zu Arousals.[4]
Das reine zentrale Schlafapnoe-Syndrom (ZSAS) ist selten. Durch Schäden im zentralen Nervensystem (ZNS), besonders im Atemzentrum, wird die Atemmuskulatur unzureichend gesteuert – das Gehirn „vergisst“ zu atmen. Die zentrale Apnoe ist meist erblich bedingt, kann aber auch aus neurologischen Schädigungen resultieren (z. B. Borreliose oder eine Instabilität der Kopfgelenke[5]). Man unterteilt die zentrale Schlafapnoe in fünf Typen: idiopathische zentrale Apnoe, Cheyne-Stokes-Atmung, reduzierte Atmung durch eine Höhenkrankheit, krankheitsbedingte und medikamentös bedingte Apnoe.
OSAS hat keine einzelne Ursache. Folgende Risikofaktoren können ein OSAS begünstigen:
Adipositas (Übergewicht)- eventuell zusätzlich auch eine Behinderung der Nasenatmung durch Polypen oder Nasenscheidewandverkrümmung oder Rhinitis vasomotorica
- vergrößerte Rachenmandeln (v. a. bei Kindern)
- konstitutionelle Erschlaffung der Rachenmuskulatur, Veranlagung
Alkoholkonsum, Schlafmittel, Nikotin, Ecstasy[6]- dolichofazialer Gesichtstyp: im Fernröntgenseitenbild eines Erwachsenen ist ein großer Unterkieferwinkel erkennbar – dadurch liegt die pharyngeale Muskulatur weit an der Rachenhinterwand, das Lumen ist verengt
- angeborene Fehlbildungen und Fehlstellungen des Unterkiefers (Pierre-Robin-Sequenz, Goldenhar-Syndrom, Kraniometaphysäre Dysplasie)
- Vergrößerung der Weichteile (z. B. Zunge), hervorgerufen durch Akromegalie
- Bindegewebskrankheiten wie z. B. Marfan-Syndrom[7]
Das ZSAS kann zusätzlich noch durch folgende Faktoren begünstigt werden:
- Herzprobleme: Herzinsuffizienz, Schlaganfall oder Vorhofflimmern
- Hirntumor
- Leben in großen Höhen
- Medikamente für die Atemwege
Schlafapnoe bei Kindern |
Das Schlafapnoe-Syndrom tritt bei Säuglingen und Kleinkindern nur selten auf, kann aber schon bei einmaligem Auftreten zu einer lebensbedrohlichen Situation führen. Bei Frühchen oder Neun-Monats-Babys, die unter erschwerten Bedingungen geboren wurden, tritt eine Schlafapnoe am ehesten auf. Vermutet wird, dass das Gehirn die Signale noch nicht vollständig an die Lunge überträgt. Unterschieden werden muss bei Säuglingen zwischen dem sogenannten periodischen Atmen, ein normales Phänomen, und der Schlafapnoe. Bei dem periodischen Atmen kann die Atmung für etwa zehn Sekunden aussetzen, um dann wieder regelmäßig fortzufahren. Bei Babys wird die Atmung mit einem Apnoemonitor aufgezeichnet. Dabei werden alle Atemaussetzer, die zu lange dauern, aufgezeichnet und ein Alarm wird ausgelöst.
Eine unregelmäßige Atmung tritt bei vielen älteren Kindern auf, häufig sind sie kurz und nicht lebensbedrohlich. Meist sind Polypen oder vergrößerte Rachenmandeln verantwortlich für apnoeähnliche Schlafzustände bei älteren Kindern.[8]
Symptome |
Die Angehörigen von OSAS-Patienten berichten meist über lautes Schnarchen, unterbrochen durch Atempausen, die mit einem heftigen, seufzenden Atemzug oder einem Schnarchlaut beendet werden. Längst nicht jeder Schnarcher aber leidet an OSAS, und nicht jeder OSAS-Patient fällt tatsächlich durch Schnarchen auf. Die beschriebene Verengung in den oberen Atemwegen kann in Einzelfällen zu einem sofortigen Verschluss führen, so dass keine Schnarchgeräusche mehr entstehen können.
Weitere Symptome des obstruktiven Schlafapnoe-Syndroms sind:[2]
- Apnoe von mindestens 10-Sekunden- bis Minutendauer
- Durchschlafstörungen
- Tagesmüdigkeit, Einschlafneigung am Tag
- Kopfschmerzen beim Erwachen („wie gerädert“)
Schwindel, vor allem nach dem Aufstehen- Mundtrockenheit beim Erwachen
- nächtliches Schwitzen
Nykturie (vermehrter Harndrang während des Schlafs / nächtliches Wasserlassen)- Sekundenschlafattacken / imperativer Schlafdrang, teils ohne Warnsignale
Konzentrationsstörungen bis hin zu Gedächtnisstörungen- depressive Verstimmung
- Impotenz, erektile Dysfunktion
- unruhiger Schlaf
Folgen |
Als Folge eines unbehandelten OSAS treten meistens weitere chronische Gesundheitsstörungen auf, und zwar Herz-Kreislauferkrankungen wie Bluthochdruck, Rechtsherzinsuffizienz,[9][10][11]Herzinfarkte sowie Schlaganfälle. Ein plötzlicher Herztod kann bei unbehandeltem OSAS mit erhöhter Wahrscheinlichkeit auftreten. Beschrieben sind auch Depressionen, Hirnschäden[12][13][14] und das gehäufte Auftreten von Stress-Erkrankungen wie Magengeschwür, Tinnitus und Hörsturz.
Diabetes mellitus, Typ 2, wird seit Anfang 2002 immer häufiger in Zusammenhang mit dem OSAS gebracht.
Es besteht ein linearer Zusammenhang zwischen dem Apnoe-Hypopnoe-Index (AHI) und der Insulin-Resistenz.[2] Der Blutzucker ist also umso höher, je mehr Atempausen pro Stunde Schlaf auftreten. Nach einer eingeleiteten nCPAP-Therapie kann die nächtliche Zuckerneubildung (Gluconeogenese) deutlich vermindert werden und die morgendlichen Blutzuckerwerte können sinken.
Patienten, deren OSAS durch Behandlung gebessert wurde, berichten von reduzierten Migräneanfällen.
Einer aktuellen Studie zufolge ist das SAS stark mit dem Auftreten von Herzkrankheiten, die einen Herzschrittmacher erforderlich machen, assoziiert.[15]
In letzter Zeit wird zunehmend darauf hingewiesen, dass ein Schlafapnoepatient, der müde oder krankhaft unkonzentriert ist, kein Fahrzeug, insbesondere mit Personenbeförderung, führen darf. Je nach Rechtslage kann sogar Strafbarkeit bestehen. Rechtsnormen sind hier z. B. die Fahrerlaubnisverordnung, der berufsgenossenschaftliche Untersuchungsgrundsatz G25 und die Richtlinien des Verbandes Deutscher Verkehrsunternehmen. Wahrscheinlich sind viele schwere Verkehrsunfälle auf eine unbehandelte Schlafapnoe zurückzuführen. Deswegen werden Früherkennungsuntersuchungen für Berufskraftfahrer gefordert. Zwei bis vier Wochen nach Beginn einer regelmäßigen nCPAP-Therapie ist die Fahrtauglichkeit in der Regel vollständig wiederhergestellt. Regelmäßige Nachuntersuchungen – auch der Therapieakzeptanz – sind notwendig. Derzeit untersuchen nur wenige arbeitsmedizinische Dienste von Verkehrsunternehmen wie den Wuppertaler Stadtwerken ihre Beschäftigten auf das Vorliegen schlafbezogener Atemstörungen wie der Schlafapnoe.
Bei Notwendigkeit müssen die nCPAP-Atemtherapiegeräte auch im Auto oder LKW bei Standzeiten mittels Bordnetz betrieben werden.
In Deutschland wird das Schlafapnoe-Syndrom auch von den Versorgungsämtern als Behinderung anerkannt:
- ohne die Notwendigkeit einer Beatmungstherapie (nCPAP, BiPAP) 0–10 Grad der Behinderung (GdB)
- mit der Notwendigkeit einer Beatmungstherapie (nCPAP, BiPAP) 20 GdB
- bei nicht durchführbarer Therapie/Beatmungstherapie mindestens 50 GdB
Diagnose |
Wichtig für die Diagnose sind die oft typische Vorgeschichte (obstruktives Schnarchen, Atemaussetzer und fehlende Erholsamkeit des Nachtschlafes) sowie Angaben zur Schlafhygiene. Die Diagnostik wird durch ein Schlafdiagnostikscreening (sog. Nicht-Labor-Monitoring) eingeleitet, welches nach entsprechender Weiterbildung und Zulassung[16][17] überwiegend durch Fachärzte für HNO bzw. Pneumologen durchgeführt wird.
Die Untersuchung mit solchen Nicht-Labor-Monitoring-Systemen (NLMS) erfolgt durch Aufzeichnung von Atemströmung (nasal flow), Atemgeräuschen, Sauerstoffsättigung im Blut mittels Pulsoxymeter, Herzfrequenz, Atembewegung des Brustkorbes und des Abdomens sowie Körperlage (Kardiorespiratorische Polygraphie) während des Schlafes zu Hause beim Patienten. Es sind verschiedene kompakte Geräte hierfür am Markt verfügbar.
Eine Schlafapnoe ist wahrscheinlich, wenn neben der klinischen Symptomatik in der Polygraphie bei einer Aufzeichnungszeit von mindestens sechs Stunden im Durchschnitt pro Stunde mehr als fünf Apnoe-/Hypopnoe-Phasen über 10 Sekunden Dauer (pathologischer Apnoe-/Hypopnoe-Index AHI: >5) mit dem charakteristischen episodischen Abfall der Sauerstoffsättigung des Blutes nachgewiesen werden. Als leichte/milde Schlafapnoe wird ein AHI von 6 bis 14 gewertet, als mittlere Schlafapnoe ein AHI von 15 bis 30 und als schwere Schlafapnoe ein AHI von über 30.
In Fällen eines auffälligen Screenings wird der Patient in ein Schlaflabor eingewiesen. Dort wird mit einer Polysomnographie die Notwendigkeit einer Behandlung weiter abgeklärt bzw. eine Behandlung eingeleitet und hinsichtlich der Effektivität kontrolliert. Bei der Polysomnographie werden zusätzlich zu den Parametern der Polygraphie ein Elektroenzephalogramm (EEG), eine Elektrookulographie (EOG), eine Elektromyographie (EMG) im Bereich der Kinn- und Beinmuskulatur sowie ein EKG aufgezeichnet und der Blutdruckverlauf, in einigen Fällen auch intrathorakale Druckschwankungen, fortlaufend registriert. Während der nächtlichen Untersuchung wird das Schlafverhalten mit einer Videoaufzeichnung dokumentiert.
In der Polysomnographie zeigt sich der Einfluss der verminderten Sauerstoffversorgung, die sich im EEG als „Schlaffragmentierung“ manifestiert. Bedingt durch den Sauerstoffmangel, der sich infolge der Atempausen wiederholt, kommt es zu ständigen Weckreaktionen (Arousals), so dass durch die Fraktionierung des Schlafes (im Vergleich zur normalen „Schlafarchitektur“) eine pathologische Reduktion der Tiefschlaf- und Traumschlafphasen resultiert.
Bei der vollständigen Polysomnographie kann zusätzlich zum AHI auch der RDI bestimmt werden. Der RDI, Respiratory Disturbance Index, bezieht die respiratorischen Ereignisse auf die im EEG belegte Schlafzeit und nicht nur auf die "Bettzeit".
Behandlung |
Konservative Therapie |
Als Behandlung werden je nach Schwere und Ursache verschiedene Methoden empfohlen, wie Gewichtsreduktion, Verzicht auf Alkohol und Nikotin sowie eventuell eine operative Behandlung von Atemwegsbehinderungen. Auch eine Stärkung der Muskulatur des Mundes und des Halses kann eine Verbesserung bewirken; es gibt positive Berichte über den Effekt von regelmäßigem Musizieren mit Blasinstrumenten, insbesondere mit einem Didgeridoo.[18] Neuere Studien zeigen, dass auch Doppelrohrblattinstrumente die Symptome lindern, während andere Musikinstrumente wirkungslos bleiben.[19][20][21]

Anwender mit nCPAP-Maske

Wirkprinzip der CPAP-Therapie
Eine Therapie des OSAS ist die CPAP-Therapie mittels CPAP-Atemtherapiegeräten (Continuous Positive Airway Pressure). Diese Geräte haben ein Gebläse, welches über einen Schlauch mit einer nCPAP-Maske verbunden ist, die mittels Kopfbändern um die Nase (oder um Mund und Nase) auf das Gesicht gedrückt wird. Mit Hilfe dieser Masken wird während der Schlafzeit in den Atemwegen ein leichter Überdruck von 5 bis 20 Millibar erzeugt. Dieser verhindert das Zusammenfallen der Atemwege und verhindert damit Apnoen und Hypopnoen. Dabei wird gleichzeitig das Schnarchen verhindert. Man spricht bei dieser Therapie auch von der „pneumatischen Schienung“ der oberen Atemwege. Es gibt verschiedene Arten solcher Masken. Man unterscheidet zwischen „Direkt-Nasal-“, „Oral-“, „Nasal-“ und „Vollgesichts-Masken“. Nach einer Eingewöhnungsphase berichten die meisten Anwender über eine deutlich bessere Schlafqualität und Rückgang bzw. Verschwinden der OSAS-Symptome. Neben der Linderung der OSAS-Symptomatik kann die CPAP-Therapie auch dabei helfen, eine medikamentenresistente Hypertonie zu lindern,[22] welche oft im Zusammenhang mit dem OSAS auftritt.
Erscheint die CPAP-Therapie dem Patienten zu anstrengend, etwa wegen des Gegendrucks beim Ausatmen, weicht man meist auf die BIPAP-Beatmung aus. In der Regel muss die Therapie lebenslang angewendet werden. Das Absetzen der Therapie kann zur Folge haben, dass die Symptome wieder auftreten. Der Schlaf wird erholsam, wenn man die Therapie regelmäßig und konstant durchführt. Manchmal ist bei Austrocknen der Nasenschleimhaut die Verordnung eines Warmbefeuchters für die Atemluft erforderlich. Die CPAP-Geräte werden im Schlaflabor auf den individuell notwendigen Beatmungsdruck eingestellt. Der Druck kann in Schlaflaboren überprüft und angepasst werden, da dieser sich im Laufe der Therapie verändern kann. Ein anderer Druck kann zum Beispiel erforderlich sein, wenn der Patient Gewicht verloren oder zugenommen hat. Auch ambulante Einstellungen und Überprüfungen sind möglich. Die Krankenkassen verlangen in letzter Zeit häufig einen Nutzungsnachweis von mehr als vier Stunden pro Nacht, wenn sie die Behandlung weiter bezahlen sollen. Hierzu zeichnet das Atemtherapiegerät auf einer Speicherkarte die Nutzungsdauer auf.
Bei unter CPAP-Beatmung weiter bestehender Tagesschläfrigkeit ist das vigilanzsteigernde Medikament Modafinil einsetzbar, welches mittlerweile in Deutschland aber nicht mehr für diese Indikation zugelassen ist (nur noch bei Narkolepsie), da es sehr häufig starke Nebenwirkungen wie Kopfschmerzen, Übelkeit, Schwindel und Durchfall verursacht. Der Einsatz von Theophyllin, welches zentral den Atemantrieb steigert, ist u. a. wegen kardialer Nebenwirkungen obsolet.
Unterkieferprotrusionsschiene |

Unterkieferprotrusionsschiene
Bei Patienten mit einem leichten bis mittelgradigen obstruktiven Schlafapnoe-Syndrom hat die intra-orale Unterkieferprotrusionsschiene ihre Wirksamkeit nachweisen können. Dabei handelt es sich um individuell nach Abformung der Zähne gefertigte, labortechnisch hergestellte, einstellbare Schienensysteme. Durch das Tragen wird die Einengung des Rachenraums verringert, die Atemwege werden im Schlaf mechanisch offen gehalten und der Atemwegswiderstand nimmt ab.[23] Das Verfahren kommt auch statt CPAP bei Intoleranz oder mangelnder Therapiecompliance zur Anwendung.[4]Metaanalysen haben gezeigt, dass Protrusionsschienen den Blutdruck ähnlich stark senken wie die CPAP-Beatmung und ebenfalls die Tagesmüdigkeit effektiv therapieren.[24][25]
Operative Therapie |
CPAP ist die am weitesten verbreitete Therapie des Schlafapnoe-Syndroms und der international anerkannte „Goldstandard“, sie ist allerdings eine nicht für alle Patienten durchführbare Dauertherapie.[26] Insbesondere bei Unverträglichkeiten konservativer Therapien gibt es für die obstruktive Schlafapnoe deshalb operative Behandlungsmöglichkeiten. Ein sinnvolles Ziel von chirurgischen Eingriffen kann die Verbesserung der Nasenluftpassage zur Verbesserung der CPAP-Compliance sein, ein anderer Ansatzpunkt sind ungewöhnlich große Gaumentonsillen und Adenoiden.[27] Chirurgische Alternativen mit Eingriffen im Halsbereich haben sich nicht durchgesetzt.
Bei der bimaxillären Operation, englisch auch Maxillomandibular Advancement, werden die physischen Ursachen der obstruktiven Schlafapnoe, die zu kleinen oder zu weit zurückliegenden Kiefer und der damit verbundene Zungengrund, welcher die oberen Atemwege verengt, behandelt.[28] Bei diesem Eingriff werden durch das Vorverlagern des Ober- und Unterkiefers die oberen Atemwege dauerhaft erweitert. Ziel der bimaxillären Operation ist eine Erhöhung der Sauerstoffkonzentration im arteriellen Blut[29] sowie eine Verbesserung der Schlafqualität.[30]
Bimaxilläre Operationen werden von spezialisierten Mund-, Kiefer- und Gesichtschirurgen durchgeführt. Generell sind bei einem solchen Eingriff die Risiken wie bei jedem operativen Eingriff von der Erfahrung des Operateurs mit diesem Eingriff abhängig, ebenso sind wie bei jedem operativen Eingriff Risiken wie Wundheilungsstörungen, Infektion, Gefäß- und vor allem Nervenverletzungen (insbesondere des im Unterkiefer verlaufenden Nervus mandibularis) und Blutungen zu beachten, über die jeder Patient individuell aufgeklärt werden muss. Speziell zu erwähnen ist das meist reversible Taubheitsgefühl im Bereich der Unterlippe und das Vorkommen von Störungen der Zahnstellung. Unmittelbar postoperativ kann es zu einer ausgedehnten Schwellung kommen, die nach circa ein bis zwei Wochen verschwindet. Operationsbedingte Schmerzen sind gering. Nach dem Eingriff sollte der Patient für circa 3–4 Wochen nicht kauen und nur flüssige und pürierte Kost zu sich nehmen.
Mit der Vorverlagerung der Kiefer geht eine Veränderung der Gesichtsform einher. Daher ist im Vorfeld eine umfangreiche Aufklärung und Beratung durch einen erfahrenen Spezialisten empfehlenswert, um zusätzlich zum medizinisch erfolgreichen auch ein ästhetisch ansprechendes Ergebnis zu erzielen. Auch haben gerade übergewichtige Patienten, Patienten mit Herzerkrankungen oder Diabetes ein erhöhtes Operationsrisiko, was viele Patienten mit Schlafapnoe betrifft. Daher ist nach den in Deutschland gültigen Leitlinien immer erst einmal eine ungefährliche Therapie mit Luft (CPAP) mit ausreichendem Zeitfenster zur Gewöhnung und durch Unterstützung erfahrener Schlafmediziner zu versuchen, was dann auch in den meisten Fällen gelingt.
Ein weiterer Ansatzpunkt stellt die Stimulationstherapie dar. Durch Stimulation des Nervus hypoglossus können über Tonussteigerung der Zungenmuskulatur nächtliche Apnoen verhindert werden.[31] Die Stimulation kann dabei atmungssynchron die gesamte rechtsseitige Zungenmuskulatur bei der Einatmung oder kontinuierlich alternierend unterschiedliche Anteile der rechtsseitigen Zungenmuskulatur während Ein- und Ausatmung[32] erfolgen. Nachdem beide Systeme in Europa schon seit 2013 zur Anwendung kommen können, wird die atmungssynchrone Stimulation seit der Freigabe durch die FDA[33] im April 2014 auch in den USA angewendet.
Operative Eingriffe werden von entsprechend spezialisierten Kieferchirurgen und/oder HNO-Ärzten durchgeführt.
In lebensbedrohlichen Situationen oder wenn alle anderen Behandlungsmethoden versagen, wird auch eine Tracheotomie (Luftröhrenschnitt) durchgeführt. Dieser drastische Eingriff wirkt immer, da die Obstruktion der oberen Atemwege umgangen wird. In seltenen Fällen wird dem Patienten ein permanenter Tubus in die Luftröhre eingesetzt, durch den im Schlaf geatmet werden kann.
Alternative Therapien |
Zahlreiche Firmen bieten auch „Anti-Schnarch-Masken“, Nasenklammern, elektrische Warngeräte, Meditationskurse, Magnetfeldmatten, ätherische Öle usw. zur Eigenbehandlung an. Diese Produkte und Methoden haben bisher keine nachgewiesene Wirksamkeit, stören in manchen Fällen den Nachtschlaf sogar zusätzlich. Außerdem verhindern oder verzögern sie den Beginn einer wirksamen Behandlung der Schlafapnoe.
Eine weitere Alternative ist die transkutane Elektrostimulation der suprahyoidalen Muskulatur, welche zu einer Vergrößerung des Lumens im Pharynx führt. Das Zungenmuskel-Training (ZMT®) muss während zweier Monate zweimal täglich durchgeführt werden.[34] Diese Methode bietet aber nur begrenzte Erfolge,[35] zudem auch nur bei mildem Schlafapnoesyndrom und kann daher nicht generell als Alternative zur CPAP-Therapie betrachtet werden.
Ausmusterung bei der Bundeswehr |
Das Schlafapnoe-Syndrom ist in Gesundheitsnummer 44 (Lunge und Mediastinum) der Zentralen Dienstvorschrift (ZDv) 46/1 aufgeführt:
- Ein nachgewiesenes Schlafapnoe-Syndrom mit Einschränkung der körperlichen und geistigen Leistungsfähigkeit mit der Notwendigkeit der apparativen Atmungstherapie ist danach als Gradation VI eingestuft, was zur Ausmusterung führt.
- Ein nachgewiesenes Schlafapnoe-Syndrom ohne wesentliche Einschränkung der körperlichen und geistigen Leistungsfähigkeit führt zur Gradation IV, dies führt seit dem 1. Oktober 2004 nach einer Änderung der Dienstvorschrift[36] ebenfalls zu einem T5 (Ausmusterung). Vorher führte dies zu einem T3 (verwendungsfähig mit Einschränkung in der Grundausbildung und für bestimmte Tätigkeiten).
Siehe Anlage 3/46[37] der Zentralen Dienstvorschrift 46/1 des Bundesministeriums der Verteidigung.
Siehe auch |
- Pickwick-Syndrom
Literatur |
Peter Spork: Das Schnarchbuch. Ursachen, Risiken, Gegenmittel. Rowohlt Taschenbuch Verlag, Reinbek 2007, ISBN 978-3-499-62207-6.
Hans-Werner Gessmann: Das Zungenmuskel-Training – eine alternative Behandlung gegen Schlafapnoe und Schnarchen. Verlag des Psychotherapeutischen Instituts Bergerhausen, Duisburg 2001, ISBN 3-928524-43-7.- Peter Hannemann: Schlafapnoe-Syndrom und Schnarchen. Ursachen, Symptome, erfolgreiche Behandlung. Jopp bei Oesch, Zürich 2000, ISBN 3-89698-113-7.
- Jürgen Schäfer: Schnarchen, Schlafapnoe und obere Luftwege. Thieme Verlag, Stuttgart 1996, ISBN 3-13-102111-X.
Weblinks |
- S2-Leitlinie Therapie der obstruktiven Schlafapnoe des Erwachsenen der Deutschen Gesellschaft für Hals-Nasen-Ohren-Heilkunde, Kopf- und Hals-Chirurgie (DGHNOKHC). In: AWMF online (Stand 2009)
Obstruktive Schlafapnoe – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)- C. Iber u. a.: The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications. 1. Auflage. American Academy of Sleep Medicine, Westchester IL 2007
- Karte der DGSM mit Schlaflaboren in Deutschland
- Interaktive Karte des Schlafapnoe Forums für Schlaflabore und Selbsthilfegruppen
Einzelnachweise |
↑ Hilmar Burchardi: Ätiologie und Pathophysiologie der akuten respiratorischen Insuffizienz (ARI). In: J. Kilian, H. Benzer, F. W. Ahnefeld (Hrsg.): Grundzüge der Beatmung. Springer, Berlin u. a. 1991, ISBN 3-540-53078-9, 2., unveränderte Aufl. ebenda 1994, ISBN 3-540-57904-4, S. 47–91, hier: S. 67 f.
↑ abc
S3-Leitlinie Nicht erholsamer Schlaf/Schlafstörungen der Deutschen Gesellschaft für Schlafforschung und Schlafmedizin (DGSM). In: AWMF online (Stand 2009)
↑ Apnoetauchen
↑ ab Riccardo A. Stoohs: Widerstandssyndrom der oberen Atemwege. In: Deutsches Ärzteblatt. Vol. 104, Nr. 12, 2007, S. A784-A789. aerzteblatt.org (PDF; 336 kB), abgerufen am 4. Februar 2013.
↑ b:Diagnostik von Instabilitäten im Bereich der Kopfgelenke
↑ U. D. McCann, F. P. Sgambati, A. R. Schwartz, G. A. Ricaurte: Sleep apnea in young abstinent recreational MDMA (“Ecstasy”) consumers. In: Neurology. 2. Dezember 2009. PMID 19955499
↑ M. Kohler, E. Blair, P. Risby, A. H. Nickol, P. Wordsworth, C. Forfar, J. R. Stradling: The prevalence of obstructive sleep apnoea and its association with aortic dilatation in Marfan’s syndrome. In: Thorax. Februar 2009. PMID 18852161
↑ Schlafapnoe bei Babys und Kleinkindern. Abgerufen am 25. Juli 2017.
↑ Cardiovascular Consequences of Obstructive Sleep Apnea
↑ Basics of Sleep Apnea and Heart Failure
↑ B. M. Sanner, M. Konermann, A. Sturm, H. J. Müller, W. Zidek: Right ventricular dysfunction in patients with obstructive sleep apnoea syndrome. In: European Respiratory Journal. Band 10, 1997, S. 2079–2083.
↑ Atemmaske verringert Hirnschäden bei Schlafapnoe In: Ärzte Zeitung. 21. September 2011.
↑ P. M. Macey: Is brain injury in obstructive sleep apnea reversible? In: Sleep. Band 35, Nummer 1, Januar 2012, S. 9–10, doi:10.5665/sleep.1572. PMID 22215912, PMC 3242693 (freier Volltext).
↑ T. T. Dang-Vu: Prefrontal dysfunction in obstructive sleep apnea: a biomarker of disease severity? In: Sleep. Band 36, Nummer 5, Mai 2013, S. 631–632, doi:10.5665/sleep.2610. PMID 23633742, PMC 3622645 (freier Volltext).
↑
W. Grimm, H. F. Becker. In: Herz. 31(3), 2006, S. 213–218. PMID 16770557, (PDF)
↑ § 135 Abs. 2 SGB V
↑ Qualitätssicherungsvereinbarung kvwl.de (PDF; 63 kB)
↑ M. A Puhan: Didgeridoo playing as alternative treatment for obstructive sleep apnoea syndrome: randomised controlled trial. In: BMJ (British Medical Journal). Band 332, 2006, S. 266–270, doi:10.1136/bmj.38705.470590.55.
↑ Christopher P. Ward, Kaki M. York, John G. McCoy: Risk of Obstructive Sleep Apnea Lower in Double Reed Wind Musicians. In: Journal of Clinical Sleep Medicine. 8(3), 15. Juni 1012, S. 251–255, doi:10.5664/jcsm.1906.
↑ Devin L. Brown, Darin B. Zahuranec, Jennifer J. Majersik, Patricia A. Wren, Kirsten L. Gruis, Michael Zupancic, Lynda D. Lisabeth: Risk of sleep apnea in orchestra members. In: Sleep Medicine. Band 10, 2009, S. 657–660, doi:10.1016/j.sleep.2008.05.013.
↑ P. J. C. Wardrop, S. Ravichandran, M. Hair, S. M. Robertson, D. Sword: Do wind and brass players snore less? A cross-sectional study of snoring and daytime fatigue in professional orchestral musicians. In: Clinical Otolaryngology. Band 36, 2011, S. 134–138, doi:10.1111/j.1749-4486.2011.02297.x.
↑ M. A. Martínez-García, F. Capote, F. Campos-Rodríguez, P. Lloberes, M. J. Díaz de Atauri, M. Somoza, J. F. Masa, M. González, L. Sacristán, F. Barbé, J. Durán-Cantolla, F. Aizpuru, E. Mañas, B. Barreiro, M. Mosteiro, J. J. Cebrián, M. de la Peña, F. García-Río, A. Maimó, J. Zapater, C. Hernández, N. Grau SanMarti, J. M. Montserrat: Effect of CPAP on blood pressure in patients with obstructive sleep apnea and resistant hypertension: the HIPARCO randomized clinical trial. In: JAMA: the Journal of the American Medical Association. Band 310, Nummer 22, Dezember 2013, S. 2407–2415, ISSN 1538-3598. doi:10.1001/jama.2013.281250. PMID 24327037.
↑ Susanne Schwarting, Ulrich Huebers, Markus Heise, Joerg Schlieper, Andreas Hauschild: Position paper on the use of mandibular advancement devices in adults with sleep-related breathing disorders. In: Sleep and Breathing. Vol. 11, Nr. 2, 2007, S. 125–126, doi:10.1007/s11325-007-0116-z, PMID 17464519, PMC 2211364 (freier Volltext) – (englisch).
↑ D. J. Bratton, T. Gaisl, A. M. Wons, M. Kohler: CPAP vs Mandibular Advancement Devices and Blood Pressure in Patients With Obstructive Sleep Apnea: A Systematic Review and Meta-analysis. In: JAMA. December 2015. PMID 26624827
↑ D. J. Bratton, T. Gaisl, C. Schlatzer, M. Kohler: Comparison of the effects of continuous positive airway pressure and mandibular advancement devices on sleepiness in patients with obstructive sleep apnoea: a network meta-analysis. In: Lancet Respir Med. December 2015. PMID 26497082
↑ A. A. Hsu, C. Lo: Continuous positive airway pressure therapy in sleep apnoea. In: Respirology. Band 8, 2003, S. 447–454.
↑ Thomas Verse, Karl Hörmann: Operative Therapie der Obstruktion bei schlafbezogenen Atmungsstörungen. In: Deutsches Ärzteblatt. Vol. 108, Nr. 13, 2011, S. 216–221, doi:10.3238/arztebl.2010.0216. aerzteblatt.org (PDF; 422 kB), abgerufen am 4. Februar 2013.
↑ J. R. Prinsell: Maxillomandibular advancement surgery for obstructive sleep apnea syndrome. In: J Am Dent Assoc. Band 133, 2002, S. 1489–1497.
↑ K. W. Lye u. a.: Quality of life evaluation of maxillomandibular advancement surgery for treatment of obstructive sleep apnea. In: J Oral Maxillofac Surg. Band 66, 2008, S. 968–972 (joms.org).
↑ M. J. Zinser, S. Zachow, H. F. Sailer: Bimaxillary ‘rotation advancement’ procedures in patients with obstructive sleep apnea: a 3-dimensional airway analysis of morphological changes. In: Int. J. Oral Maxillofac. Surg. Vol. 42, Issue 5, S. 569–578.
↑ Patrick J. Strollo, Ryan J. Soose, Joachim T. Maurer, Nico de Vries, Jason Cornelius, Oleg Froymovich, Ronald D. Hanson, Tapan A. Padhya, David L. Steward, M. Boyd Gillespie, B. Tucker Woodson, Paul H. Van de Heyning, Mark G. Goetting, Oliver M. Vanderveken, Neil Feldman, Lennart Knaack, Kingman P. Strohl: Upper-Airway Stimulation for Obstructive Sleep Apnea. In: New England Journal of Medicine. 370, 2014, S. 139–149, doi:10.1056/NEJMoa1308659.
↑ Michael Friedman, Ofer Jacobowitz, Michelle S. Hwang, Wolfgang Bergler, Ingo Fietze, P. Rombaux, G. B. Mwenge, S. Yalamanchali, J. Campana, J. T. Maurer: Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. In: The Laryngoscope. Band 126, Nr. 11, November 2016, ISSN 1531-4995, S. 2618–2623, doi:10.1002/lary.25909, PMID 27010361.
↑ Offizielle Freigabe der UAS-Therapie durch die FDA.
↑ Th. Verse: Transkutane Elektrostimulationstherapie bei obstruktiver Schlafapnoe. In: MedReport. Nr. 32, 26. Jg., Blackwell Verlag, Berlin 2002.
↑ Winfried J. Randerath: Zungenmuskeltraining Durch Elektrostimulation in Der Therapie Des Obstruktiven Schlafapnoesyndroms. In: Somnologie: Schlafforschung Und Schlafmedizin. 8, 1, 2004, S. 14.
↑ Wegfall des Verwendungsgrades T3 (PDF; 126 kB)
↑ Anlage 3/45 der Zentralen Dienstvorschrift 46/1 des Bundesministeriums der Verteidigung (PDF; 58 kB)
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |