Diphtherietoxin
| Diphtherietoxin (Corynephage β) | ||
|---|---|---|
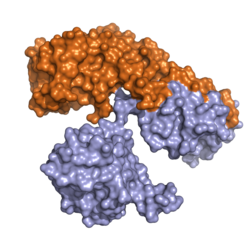 | ||
| Oberflächenmodell nach PDB 1DDT. Kette A (Enzym) orange, Kette B (Transporter) hellblau. | ||
Masse/Länge Primärstruktur | 535 = 193+342 Aminosäuren | |
Sekundär- bis Quartärstruktur | A+B | |
| Bezeichner | ||
| Gen-Name(n) | DT | |
| Externe IDs |
| |
| Enzymklassifikation | ||
EC, Kategorie | 2.4.2.36, Glycosyltransferase | |
| Reaktionsart | Übertragung eines ADP-Riboserests | |
| Substrat | NAD+ + EF-2 | |
| Produkte | NAD + EF-2(defekt) | |
Das Diphtherietoxin (DT) ist ein Exotoxin aus Corynebacterium diphtheriae, dem Erreger der Diphtherie und hemmt die Proteinsynthese bei Eukaryoten und Archaeen durch Blockierung der Translation während der Elongationsphase. Das hochmolekulare Toxin zählt zu den Lektinen. Die genetische Information ist im Phagen β enthalten und nur wenn das Bakterium von ihm infiziert wird, kann es selbst das Toxin bilden.
Wirkungsweise |
Das Toxin besteht aus zwei Proteinen Toxin A und Toxin B, die über Disulfidbrücken miteinander verbunden sind und bindet selektiv an die 80 S-Ribosomen von eukaryotischen Zellen. Seine Masse beträgt etwa 61 kDa. Das Eindringen in die Zelle unterliegt dem gleichen Mechanismus wie bei Ricin:
Die B-Kette heftet sich an einen Rezeptor auf der Zelloberfläche, dadurch spaltet sich das Toxin in ein 21 kDa A-Fragment und ein 40 kDa B-Fragment, wobei das A-Fragment in die Zelle eindringt. Diesen Mechanismus hat das Diphtherietoxin mit etlichen anderen Bakterientoxinen gemeinsam, es gehört zur Gruppe der AB-Toxine.
Das Ziel der enzymatischen Aktivität des Diphtherietoxin A ist der Elongationsfaktor EF-2, der die Translation bei der Proteinsynthese von Eukaryoten katalysiert. EF-2 enthält Diphthamid, einen ungewöhnlichen Aminosäurerest mit unbekannter Funktion, der aus Histidin gebildet wird. Das A-Fragment des Toxins katalysiert die kovalente Modifikation dieses Diphthamids. Dabei wird ein ADP-Ribosylrest aus NAD+ unter Abspaltung von Nicotinamid auf das Diphthamid übertragen. Man spricht von einer ADP-Ribosylierung. Dadurch hemmt das Diphtherietoxin die Fähigkeit des EF-2, die Translation der wachsenden Polypeptidkette auszuführen. Die Proteinsynthese stoppt, und dies ist die Ursache für die bemerkenswerte Toxizität des Diphtherietoxins. Das Diphtherietoxin ist der wirksame Bestandteil in Diphtherieimpfstoffen.
Ähnliche Toxine |
Auch andere Gifte, die von Krankheitserregern stammen, bestehen aus zwei miteinander verbundenen Peptidketten, deren eine an einen Rezeptor auf der Zelloberfläche bindet und so der anderen Kette Zutritt in das Zellinnere verschafft wie zum Beispiel das Choleratoxin, das Pertussistoxin (Keuchhustentoxin) und das Milzbrandtoxin. Allerdings sind die toxischen Mechanismen dieser Toxine unterschiedlich.
Den identischen Mechanismus der NAD-abhängigen ADP-Ribosylierung nutzt auch das Exotoxin A aus Pseudomonas aeruginosa.
Literatur |
- Stryer Lubert: Biochemie. Verlag Spektrum der Wissenschaft, Heidelberg 1990, ISBN 3-89330-690-0, S. 791–796.