Sonografie
Sonografie (Sonographie), auch Echografie oder umgangssprachlich „Ultraschall“ genannt, ist ein bildgebendes Verfahren mit Anwendung von Ultraschall zur Untersuchung von organischem Gewebe in der Medizin und Veterinärmedizin sowie von technischen Strukturen.
Das Ultraschallbild wird auch Sonogramm genannt.
 Mediendatei abspielen
Mediendatei abspielenMittels Sonografie erstellte Videoaufnahme eines elf Wochen alten Fötus
Inhaltsverzeichnis
1 Anwendungen in der Medizin
1.1 Anwendungsbereiche
1.2 Zugänglichkeit von Organen
1.3 Vorteile
1.4 Nachteile
2 Geschichte der Sonografie
3 Bildgebung
3.1 Überblick
3.2 Puls-Echo-Verfahren
4 Darstellungsmethoden
4.1 A-Mode
4.2 B-Mode
4.2.1 2D-Echtzeitmodus (2D-realtime)
4.2.2 M-Mode
4.3 Mehrdimensionale Anwendung
5 Doppler-Verfahren
5.1 Prinzip
5.2 Die Verfahren im Einzelnen
6 Weitere Techniken
7 Bildfehler
8 Sicherheitsaspekte
8.1 Kavitation
8.2 Wärme
8.3 Allgemeines
9 Physikalische Grundlagen
9.1 Schallphänomene
9.1.1 Reflexion
9.1.2 Streuung
9.1.3 Absorption
9.2 Erzeugung und Nachweis von Ultraschall
9.3 Das Schallfeld eines kreisförmigen Ultraschallwandlers
9.4 Das Schallfeld eines fokussierten Ultraschallwandlers
9.5 Auflösungsvermögen
9.5.1 Lateral
9.5.2 Axial
9.5.3 Übliche Werte
10 Der Ultraschall-Markt
11 Siehe auch
12 Literatur
13 Weblinks
14 Einzelnachweise
Anwendungen in der Medizin |
Anwendungsbereiche |

Herzsonografieuntersuchung bei einem Säugling
Ein wesentlicher Vorteil der Sonografie gegenüber dem in der Medizin ebenfalls häufig verwendeten Röntgen liegt in der Unschädlichkeit der eingesetzten Schallwellen. Auch sensible Gewebe wie bei Ungeborenen werden nicht beschädigt, die Untersuchung verläuft schmerzfrei.
Neben der Herztonwehenschreibung (Kardiotokografie) ist sie ein Standardverfahren in der Schwangerschaftsvorsorge. Eine spezielle Untersuchung der Pränataldiagnostik zur Erkennung von Entwicklungsstörungen und körperlichen Besonderheiten ist der Feinultraschall.
Die Sonografie ist das wichtigste Verfahren bei der Differentialdiagnose eines akuten Abdomens, bei Gallensteinen oder bei der Beurteilung von Gefäßen und deren Durchlässigkeit, vor allem an den Beinen. Weiterhin wird sie standardmäßig zur Untersuchung der Schilddrüse, des Herzens – dann Echokardiografie oder Ultraschallkardiografie (UKG) genannt –, der Nieren, der Harnwege und der Harnblase benutzt. Durch den Einsatz von Echokontrastverstärkern (Kontrastmittel) ist in geeigneten Fällen eine weitere Verbesserung der Diagnostik möglich.
In der Gynäkologie werden mit einer vaginal eingeführten Sonde Eierstöcke und Gebärmutter betrachtet.
Die Ultraschallanwendung ist geeignet zur Erstbeurteilung und für Verlaufskontrollen, insbesondere bei medikamentösen oder strahlentherapeutischen Behandlungen bösartiger Erkrankungen.
Mit Ultraschall können krebsverdächtige Herde erkannt und erste Hinweise auf ihre Bösartigkeit gewonnen werden. Darüber hinaus sind ultraschallgesteuerte Biopsien und Zytologien (Entnahmen von Gewebeproben oder freier Flüssigkeit) durchführbar.
Die Aufnahme von Ultraschallbildsequenzen insbesondere in Verbindung mit Kontrastmitteln erlaubt die Beurteilung der Perfusion verschiedener Organe wie z. B. Leber oder Gehirn durch die Verlaufsvisualisierung des Kontrastmittelniveaus im Blutkreislauf. Dies unterstützt z. B. eine frühzeitige Diagnose eines ischämischen Schlaganfalls.
Eine aktuelle Entwicklung ist die Diagnose von Knochenbrüchen und deren Verlaufskontrolle. Insbesondere bei Brüchen im Kindesalter ist in bestimmten Regionen eine ultraschallbasierte Darstellung von Frakturen mit einer Genauigkeit möglich, die Röntgenbilder überflüssig machen kann. Zum gegenwärtigen Zeitpunkt ist der Einsatz dieser Fraktursonografie bei handgelenksnahen Unterarmfrakturen, Ellenbogen- und Oberarmbrüchen möglich.
Zugänglichkeit von Organen |
Alle wasserhaltigen, blutreichen Organe sind für den Ultraschall gut untersuchbar. Schlecht untersuchbar sind alle gashaltigen oder von Knochen bedeckten Organe, zum Beispiel der Darm bei Blähungen, die Lunge, Gehirn und das Knochenmark. Manche Organe sind im Normalzustand nur schwierig, im krankhaft vergrößerten Zustand dagegen gut erkennbar (Blinddarm, Harnleiter, Nebennieren).
Spezielle Sondentypen wie die Endoskopsonde, die in den Körper eingeführt werden, machen eine Untersuchung innerer Organe, genannt Endosonografie, möglich. So führt man beispielsweise eine Sonde vaginal ein zur Untersuchung der Eierstöcke, anal zur Durchschallung der Prostata oder oral zur Betrachtung des Magens oder – häufiger – des Herzens (TEE).
Gut untersuchbare Organe:
Aorta abdominalis – Arterien und Venen (außer im Schädel), z. B. Halsschlagadern, Untere Hohlvene
Herz – Leber – Milz – Nieren – Pankreas
Gallenblase – Gallengang
Darm (teilweise)- Harnleiter
- Hoden
- Pleura
Schilddrüse – Speicheldrüsen- Lymphknoten
- Knochen (im Rahmen der Fraktursonografie)
- Haut
- Zugängliche Muskeln
Zwerchfell (je nach Fragestellung)
Zugänglichkeit nur bedingt oder durch Endoskopsonde, eventuell auch durch die volle Harnblase:
- Enddarm
- Harnleiter
- Prostata
Gebärmutter – Eierstöcke- Nebenniere
Magen – Ösophagus- Sehnen
Schlecht zu untersuchen:
Gehirn (Ausnahme: Säuglingsgehirn durch die offene Fontanelle) – Nerven
Wirbelsäule – Rückenmark- Inneres von Knochen – Inneres von Gelenken
Herzkranzgefäße (IVUS)
Luftröhre – Lunge
Besonderheiten bei Kindern und Ungeborenen:
Bei Kindern können sehr viel mehr Organe als beim Erwachsenen untersucht werden, da die Verknöcherung noch nicht abgeschlossen ist oder bei Neugeborenen erst beginnt (z. B. ist die Fontanelle noch offen):
- Gehirn – Hirngefäße
- Wirbelsäule – Rückenmark
- Nebenniere
- im Wachstumsalter bis 12 Jahre Fraktursonografie
Das Ungeborene kann in der Gebärmutter nahezu komplett untersucht werden, da noch keinerlei Gasüberlagerung vorliegt und die Knochenbildung erst am Anfang steht:
- auch Lunge – Magen – Extremitätenknochen u. a.
Vorteile |
Die Ultraschalldiagnostik wird heute von fast allen medizinischen Fachdisziplinen genutzt. Gründe liegen in der risikoarmen, nichtinvasiven, schmerzlosen und strahlenexpositionsfreien Anwendung, der hohen Verfügbarkeit und der schnellen Durchführung. Die Anschaffungs- und Betriebskosten sind im Vergleich zu anderen bildgebenden Verfahren wie der Computertomografie (CT) oder Magnetresonanztomografie (MRT) geringer. Außerdem entfallen aufwendige Strahlenschutzmaßnahmen und -belehrungen. Eine freie Schnittführung der Sonden erlaubt eine Kontrolle über das gewünschte Schnittbild in Echtzeit. Die Doppler-Sonografie kann als einzige etablierte Methode Flüssigkeitsströme (vor allem den Blutfluss) dynamisch darstellen.
Die verwendeten Kontrastmittel verlassen als einzige nicht die Blutbahn. Hiermit wird eine präzise Diagnostik insbesondere von Leberveränderungen möglich. Die Menge benötigten Kontrastverstärkers ist mit 1 bis 2 ml um das ca. 100fache kleiner als bei CT und MRT, die bislang bekannten Nebenwirkungen sind wesentlich seltener (Allergie, Auslösung von Herzattacken und Asthmaanfällen).
Nachteile |
Das Verfahren hat in tief gelegenen Geweben eine geringere Raumauflösung als die CT und MRT. Auch die Weichteil-Kontrastauflösung kann der bei der MRT unterlegen sein. Gas und Knochen verhindern die Ausbreitung der Ultraschallwellen. Daher ist die Sonografie bei gasgefüllten Organen (Lunge, Darm) und unter Knochen (Schädel, Rückenmark) erschwert. Anders als bei anderen bildgebenden Verfahren gibt es keine standardisierte Ausbildung. Daher bestehen große qualitative Unterschiede in den diagnostischen Fähigkeiten der Anwender.
Die Doppler-Sonografie ist während der Schwangerschaft nicht völlig risikofrei. Sie kann zu einem biologisch signifikanten Temperaturanstieg im durchschallten Gewebe führen. Insbesondere aufgrund der potentiellen Gefahr einer Schädigung zerebraler Strukturen wird die Doppler-Sonografie auf die zweite Schwangerschaftshälfte sowie auf Fälle bestimmter Indikationen beschränkt (wie etwa Verdacht auf fetale Fehlbildungen oder abnormales Herzfrequenzmuster). Bei der Verwendung der Doppler-Sonografie muss daher eine genaue Abwägung zwischen dem Nutzen und den Risiken der Untersuchung erfolgen.[1]
Geschichte der Sonografie |
Der Grundgedanke der Sichtbarmachung von Strukturen durch Schall geht auf militärische Anwendungen des seit 1880 bekannten Effekts zur Erzeugung piezoelektrischer Schallwellen zurück. Während des Ersten Weltkrieges übertrug der Franzose Paul Langevin mittels Quarzkristallen erzeugte Ultraschallwellen ins Wasser und entwickelte so ein Verfahren (Echolot) zur Ortung von Unterseebooten. Zu medizinischen Anwendungen eignete sich das Verfahren nicht, denn die Intensität der Schallwellen war so stark, dass von ihnen getroffene Fische zerbarsten. Diese Form der Anwendung wurde mit der Entwicklung von ASDIC und Sonar durch US-Amerikaner und Briten im Zweiten Weltkrieg fortgesetzt.
In der Zeit zwischen den Kriegen entwickelten der Russe S. J. Sokoloff und der US-Amerikaner Floyd A. Firestone ultraschallgestützte Verfahren zur Aufdeckung von Materialfehlern in Werkstoffen. Eine erste medizinische Anwendung erfolgte 1942 durch den Neurologen Karl Dussik (1908–1968), der einen Seitenventrikel des Großhirns mittels A-Mode-Messung (Amplitudendarstellung) darstellte. Er nannte sein Verfahren Hyperphonographie.
Seit dem Ende der 1940er Jahre entwickelte sich die Sonografie gleichzeitig innerhalb verschiedener medizinischer Fachrichtungen. Erste kardiologische Untersuchungen mittels A-Mode-Messungen wurden durch Wolf-Dieter Keidel vorgenommen, erste M-Mode-artige Messungen (zeitlich aufgereihte Amplitudenverläufe) führten Inge Edler und Carl Helmut Hertz an der Lund-Universität in Schweden durch. Etwa gleichzeitig wurden von dem Engländer John Julian Wild (1914–2009, immigrierte nach dem Zweiten Weltkrieg in die USA), und den US-Amerikanern Douglass H. Howry (1920–1969) und Joseph H. Holmes (1902–1982) erste B-Mode-artige Schnittbilder (bewegter Strahl, Helligkeitsdarstellung ähnlich Impulsradar) aus dem Bereich des Halses und des Abdomens erzeugt. Die hierzu angewendete Methode war das Compound-Verfahren, bei dem die Versuchsperson in einer wassergefüllten Tonne saß und die Ultraschallsonde auf einer Kreisbahn um sie herumwanderte.
Im selben Zeitraum erfolgten erste Anwendungen in der Augenheilkunde (G. H. Mundt und W. F. Hughes, 1956) sowie der Gynäkologie (Ian Donald). Eine erste Anwendung des Doppler-Prinzips (Bewegungsdetektion anhand des Dopplereffektes) erfolgte 1959 durch den Japaner Shigeo Satomura (1919–1960), das sich schnell einen Platz in der Angiologie und der Kardiologie erschloss. Farbkodierte Doppler-Darstellungen waren jedoch erst seit den 1980er Jahren mit der Verfügbarkeit leistungsstarker Rechner möglich.
Bildgebung |
Überblick |
Ultraschall ist Schall mit einer Frequenz oberhalb der menschlichen Hörgrenze, ab 20 kHz bis 1 GHz. In der Diagnostik verwendet man Frequenzen zwischen 1 und 40 MHz bei einer mittleren Schallintensität von 100 mW/cm². Ein Ultraschallgerät enthält eine Elektronik für die Schallerzeugung, Signalverarbeitung und -darstellung, außerdem Schnittstellen für einen Monitor und Drucker sowie für Speichermedien oder Videokameras. Per Kabel daran angeschlossen ist eine auswechselbare Ultraschallsonde, auch Schallkopf genannt.

Sonden
Die Ultraschallwellen werden mit in der Sonde angeordneten Kristallen durch den piezoelektrischen Effekt erzeugt und auch wieder nachgewiesen. Von Bedeutung für die Schallausbreitung in einem Material ist die Impedanz, also der Widerstand, der der Ausbreitung von Wellen entgegenwirkt. An der Grenzfläche zweier Stoffe mit großem Impedanzunterschied wird der Schall stark reflektiert. Dieser Unterschied ist zwischen Luft und z. B. Wasser besonders stark ausgeprägt (siehe unten im Kapitel Physikalische Grundlagen), deshalb muss die Ultraschallsonde mittels eines stark wasserhaltigen Gels angekoppelt werden, damit der Schall nicht von Lufteinschlüssen zwischen dem Sondenkopf und der Hautoberfläche reflektiert wird.

Vaginale Ultraschallsonde
Die Sonde sendet kurze, gerichtete Schallwellenimpulse aus, die an Gewebe-Grenzschichten und in inhomogenen Geweben unterschiedlich stark reflektiert und gestreut werden, was als Echogenität bezeichnet wird. Aus der Laufzeit der reflektierten Signale kann die Tiefe der reflektierenden Struktur ermittelt werden. Die Stärke der Reflexion wird vom Ultraschallgerät als Grauwert auf einem Monitor dargestellt. Strukturen geringer Echogenität werden dunkel bzw. schwarz, Strukturen hoher Echogenität werden hell oder weiß dargestellt. Gering echogen sind vor allem Flüssigkeiten wie Harnblaseninhalt und Blut. Eine hohe Echogenität besitzen Knochen, Gase und sonstige stark Schall reflektierende Material-Grenzflächen.
Von den Monitorbildern werden zur Dokumentation Ausdrucke, sogenannte Sonogramme, oder gelegentlich Videoaufnahmen gemacht. Schwangeren wird häufig auch ein Bild ihres ungeborenen Kindes überlassen.
Ein verwandtes Untersuchungsverfahren ist die Optische Kohärenztomografie. Dort wird jedoch Licht statt Schall verwendet, dementsprechend sind die Eindringtiefen gering. Es wird nicht die Laufzeit, sondern die relative optische Weglänge anhand von Interferenz ausgewertet.
Puls-Echo-Verfahren |
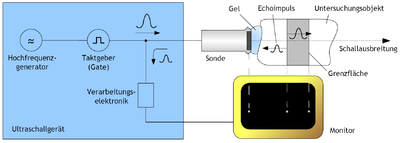
Schematischer Ablauf des Echo-Impuls-Verfahrens
Die Bildgebung mit einem Ultraschallgerät erfolgt nach dem sogenannten Impuls-Echo-Verfahren. Ein elektrischer Impuls eines Hochfrequenzgenerators wird im Schallkopf durch den piezoelektrischen Effekt in einen Schallimpuls umgesetzt und ausgesendet. Die Schallwelle wird an Inhomogenitäten der Gewebestruktur teilweise oder vollständig gestreut und reflektiert. Im ersten Fall (teilweise Reflexion/Streuung) verliert der Wellenzug Energie und läuft mit schwächerem Schalldruck weiter, solange, bis durch Absorptionseffekte die Schallenergie vollständig in Wärme umgesetzt ist. Ein zurücklaufendes Echo wird im Schallkopf in ein elektrisches Signal gewandelt. Anschließend verstärkt eine Elektronik das Signal, wertet dieses aus und kann es auf verschiedene Weise an den Anwender ausgeben, beispielsweise auf einem Monitor (siehe Darstellungsmethoden).
Der darauffolgende Schallimpuls wird bei den zweidimensionalen Verfahren (wie dem am häufigsten benutzten B-Mode) durch automatisches mechanisches oder elektronisches Schwenken der schallerzeugenden Sonde in eine leicht andere Richtung ausgestrahlt. Dadurch scannt die Sonde einen gewissen Bereich des Körpers und erzeugt ein zweidimensionales Schnittbild.
Der nächste Impuls kann erst ausgesendet werden, wenn alle Echos des vorherigen Ultraschallimpuls abgeklungen sind. Somit ist die Wiederholrate abhängig von der Eindringtiefe; das ist die maximale Reichweite in das Untersuchungsobjekt hinein. Die Eindringtiefe des Schalls ist umso kleiner, je größer die Frequenz ist. Je größer allerdings die Frequenz, desto höher ist das örtliche Auflösungsvermögen, also die Fähigkeit, nahe beieinanderliegende Objekte auseinanderhalten zu können. Es muss also stets die höchstmögliche Frequenz gewählt werden, die gerade noch eine Untersuchung in der gewünschten Tiefe ermöglicht, um die bestmögliche Auflösung zu erreichen.
Beispielsweise liegt das Herz etwa 15 cm tief. Die zu verwendende Frequenz fdisplaystyle f
- Δt=Δsc=0,15m1500ms=0,0001s=100μsdisplaystyle Delta t=frac Delta sc=frac 0,15,mathrm m 1500,mathrm frac ms =0,0001,mathrm s =100,mathrm mu s
mit c=displaystyle c=

Darstellungsmethoden |

A-Mode-Scan Signalamplitude gegen Impulsverzögerung
Eine Ultraschalluntersuchung kann je nach Anforderung mit verschiedenen Ultraschallsonden und unterschiedlicher Auswertung und Darstellung der Messergebnisse durchgeführt werden, was man als Mode (engl. für: Methode, Verfahren) bezeichnet. Die Bezeichnungen in der Raster Ultraschallmikroskopie (engl.: Scanning Acoustic Microscopy, SAM) sind aufgrund der Fokussierung des Strahles leicht unterschiedlich und bezeichnen primär die unterschiedlichen Dimensionen (A-, B-, C-Scan mode).
A-Mode |
Die erste angewandte Darstellungsform war die A-Mode (A steht für Amplitude Mode Scan, also die Aufzeichnung des Amplitudenverlaufes). Das von der Sonde empfangene Echo wird in einem Diagramm dargestellt, wobei auf der x-Achse (Zeitachse) die Eindringtiefe und auf der y-Achse die Echostärke abgetragen wird. Je höher der Ausschlag der Messkurve, desto echogener ist das Gewebe in der angegebenen Tiefe. Der Name des Modus beruht auf der zeitabhängigen Verstärkung (bis zu 120 dB) der Signale durch die Auswerteelektronik im Ultraschallgerät (time gain compensation), weil eine größere Laufstrecke der Wellen aus tieferen Schichten wegen der Absorption zu geringerer Signalamplitude führt. Der A-Mode wird beispielsweise in der HNO-Diagnostik verwendet, um festzustellen, ob die Nasennebenhöhlen mit Sekret gefüllt sind.
B-Mode |

2D-Sonogramm eines Menschenfötus von neun Wochen
B-Mode (B für englisch brightness modulation) ist eine andere Darstellung der Information des Amplituden-Modus, bei der die Echointensität in eine Helligkeit umgesetzt wird.
Durch mechanisches Bewegen der Sonde überstreicht der Messstrahl eine Fläche in einer Ebene ungefähr senkrecht zur Körperoberfläche. Der Grauwert eines Bildpunktes auf dem Bildschirm ist ein Maß für die Amplitude eines Echos an dieser Stelle.
2D-Echtzeitmodus (2D-realtime) |

Sonografie einer normalen (links) und entzündeten (rechts) Hüfte eines Kindes. Unten nachträglich blau gefärbt: Knochengrenzen (jeweils links Schaft, rechts Kopfkern, getrennt durch Wachstumszone) rot gefärbt: Kapsel.
Im 2D-Echtzeitmodus, der derzeit häufigsten Anwendung des Ultraschalls, wird ein zweidimensionales Schnittbild des untersuchten Gewebes durch automatische Verschwenkung des Messstrahls und Synchronisierung der B-mode-Darstellung in Echtzeit erzeugt. Das Schnittbild wird dabei aus einzelnen Linien zusammengesetzt, wobei für jede Linie ein Strahl ausgesendet und empfangen werden muss. Die Form des erzeugten Bildes hängt dabei vom eingesetzten Sondentyp ab. Der 2D-Echtzeitmodus kann mit anderen Verfahren wie dem M-Mode oder der Doppler-Sonografie gekoppelt werden. Je nach Eindringtiefe und Sondentyp können nur einige wenige oder bis zu über hundert zweidimensionale Bilder pro Sekunde dargestellt werden.
M-Mode |

Hundeherz, 2D/M-Mode. Die Bewegung des Herzmuskels wird entlang der senkrechten Linie im (oberen) 2D-Bild im unteren M-Bereich aufgetragen
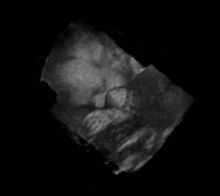
3D-Darstellung eines menschlichen Fötus. Deutlich erkennbar sind Gesicht und eine Hand.
Eine weitere häufig eingesetzte Darstellungsform ist der M- oder TM-Mode (englisch für (time) motion). Dabei wird ein Strahl bei einer hohen Impulswiederholungsfrequenz (1000 Hz – 5000 Hz) eingesetzt. Die Amplitude des Signals wird auf der vertikalen Achse dargestellt; die von den hintereinander liegenden Impulsen erzeugten Echozüge sind auf der horizontalen Achse gegeneinander verschoben. Diese Achse stellt also die Zeitachse dar.
Bewegungen des Gewebes bzw. der untersuchten Strukturen haben Unterschiede in den einzelnen Impulsechos zur Folge, es lassen sich Bewegungsabläufe von Organen eindimensional darstellen. Die M-Mode-Darstellung ist häufig mit dem B- bzw. 2D-Mode gekoppelt.
Ihre Hauptanwendung findet diese Untersuchungsmethode in der Echokardiografie, um Bewegungen einzelner Herzmuskelbereiche und der Herzklappen genauer untersuchen zu können. Die zeitliche Auflösung dieses Modus ist bestimmt durch die maximale Wiederholrate der Schallimpulse und beträgt schon bei 20 cm Tiefe über 3 kHz.
Mehrdimensionale Anwendung |
Als weitere Applikation wurde in den letzten Jahren (Anfang des 21. Jahrhunderts) die dreidimensionale Echografie entwickelt. Der 3D-Ultraschall produziert räumliche Standbilder, und der 4D-Ultraschall (auch genannt Live-3D: 3D plus zeitliche Dimension) lässt dreidimensionale Darstellung in Echtzeit zu. Für ein dreidimensionales Bild wird zusätzlich zum Scan in einer Ebene ein Schwenk der Ebene vollzogen. Der Flächenscanwinkel wird gleichzeitig mit dem zweidimensionalen Bild abgespeichert. Eine weitere Möglichkeit besteht in der Verwendung einer zweidimensionalen Anordnung von Ultraschallwandlern in einem sogenannten Phased Array (siehe Ultraschallsonde), bei der nicht mechanisch, sondern elektronisch ein Schwenk des Strahles durchgeführt wird.
Die Daten werden für die Bildverarbeitung und Visualisierung von einem Rechner in eine 3D-Matrix eingetragen. So können dann Darstellungen von Schnittebenen aus beliebigen Blickwinkeln auf das Objekt erzeugt oder virtuelle Reisen durch den Körper gestaltet werden. Um Bewegungsartefakte durch die Herztätigkeit zu vermeiden, wird die Aufnahme mittels EKG gesteuert.
Doppler-Verfahren |
Die Aussagekraft der Sonografie kann erheblich durch die Anwendung des Doppler-Effekts erhöht werden. Man unterscheidet eindimensionale Verfahren (Pulsed-Wave-Doppler, Continuous-Wave-Doppler, auch als D-mode bezeichnet) von zweidimensionalen, farbkodierten Anwendungen (Farbdoppler – F-mode). Die Kombination B-Bild mit Pulsed-Wave-Doppler (PW-Doppler) nennt man auch Duplex.[2]
Doppler-Verfahren werden benutzt zur Bestimmung von Blutfluss-Geschwindigkeiten, zur Entdeckung und Beurteilung von Herz(klappen)fehlern, Verengungen (Stenosen), Verschlüssen oder Kurzschlussverbindungen (Shunts), siehe Farbkodierte Doppler-Sonografie.
Prinzip |

Winkel zwischen Richtung des Blutflusses und Schallstrahl

Messfehler von 7,5° bei zwei verschiedenen Winkeln. Der Winkelfehler hat größere Auswirkungen bei großen Winkeln.
Der Doppler-Effekt tritt immer dann auf, wenn Sender und Empfänger einer Welle sich relativ zueinander bewegen. Zur Bestimmung der Blutflussgeschwindigkeit in den Blutgefäßen oder im Herzen detektiert man das von den Blutkörperchen (Erythrozyten) reflektierte Echo. Das reflektierte Signal ist um eine bestimmte Frequenz im Vergleich zur vom Schallkopf ausgesandten Frequenz verschoben: die Doppler-Frequenz. Von dem „ruhenden“ Sender, dem Schallkopf, geht eine Welle der Frequenz fdisplaystyle f




Δf1=2fvccosθdisplaystyle Delta f_1=2ffrac vccos theta.
Aus ihrem Vorzeichen lässt sich die Flussrichtung rekonstruieren. Bei gegebener Geschwindigkeit ist die Frequenzverschiebung umso größer, je größer die Sendefrequenz fdisplaystyle f

Zur exakten Geschwindigkeitsmessung ist die Bestimmung des Winkels (Doppler-Winkel) zwischen Schallausbreitungsrichtung und Bewegungsrichtung des Erythrozyten (Richtung des Blutgefäßverlaufes) notwendig. Da das Doppler-Prinzip winkelabhänging ist und die Kosinus-Funktion in die Geschwindigkeitsberechnung eingeht, kommt es infolge des sich mit zunehmendem Winkel ändernden Anstiegs der Kosinus-Funktion zu unterschiedlich starken Einflüssen gleicher Winkelmessfehler auf die errechnete Geschwindigkeit. Da sich Bewegungen des Schallkopfes in der Realität kaum vermeiden lassen, nehmen die Fehler, die durch diese Variation des Winkels entstehen, überproportional zu, wenn der Winkel zwischen Schallausbreitung und Gefäßrichtung untersuchungsbedingt variiert. Daher wird allgemein empfohlen, Aussagen zu Geschwindigkeiten bei Untersuchungen mit einem Doppler-Winkel > 60° zu unterlassen. Die Abhängigkeit vom Winkel lässt sich aber eliminieren, beispielsweise durch Verwendung von Stereomessköpfen.
Die Verfahren im Einzelnen |
Beim Continuous Wave Doppler (CW-Doppler)-Verfahren arbeiten ein Sender und ein Empfänger im Schallkopf gleichzeitig und kontinuierlich. Durch Mischen mit geeigneten Hochfrequenzsignalen und mit elektronischen Filtern lässt sich aus der zurückkommenden Welle in der Auswerteelektronik das Spektrum der Doppler-Frequenzen bzw. Geschwindigkeiten und auch die Richtung bestimmen. Nachteil bei diesem Verfahren ist, dass die Gewebstiefe, aus der das Doppler-Echo stammt, nicht bestimmbar ist. Andererseits können auch relativ hohe Geschwindigkeiten registriert werden.
Dagegen kann man beim Pulsed Wave Doppler (PW-Doppler) für eine ortsselektive Geschwindigkeitsmessung im konventionellen B-Mode das sogenannte Gate festlegen. Es wird dann nur die Geschwindigkeit von Blutteilchen gemessen, die durch dieses Gate fließen. Von einem sowohl als Sender als auch als Empfänger fungierenden Wandler werden Ultraschall-Signale geringer Dauer ausgeschickt. Die axiale Ortsauflösung ist ein Maß für das Vermögen des Gerätes, in Ausbreitungsrichtung eines Impulses nahe beieinanderliegende Objekte unterscheiden zu können. Je besser die axiale Ortsauflösung sein soll, desto größer muss die Bandbreite des Sendesignals sein. Üblicherweise werden daher sehr kurze Impulse von ungefähr 2–3 Wellenzügen verwendet. Je geringer die Impulsdauer ist, desto unbestimmter ist seine Frequenz und umso größer die Bandbreite. Da kleine Doppler-Verschiebungen aufgrund des im Signal vorhandenen Signalrauschens an einem einzigen Wellenpaket nicht mehr sichtbar sind, bestimmt man die Doppler-Frequenz mit einem Verfahren unter Benutzung mehrerer verschiedener aufeinanderfolgender Sendepulse. Letztlich misst man dabei immer die Änderung der Entfernung der im Messvolumen vorhandenen Streupartikel pro Zeiteinheit.[3] Es handelt sich dabei um eine indirekte Messung der Doppler-Frequenz im Zeitbereich. Beim Überschreiten einer von der Pulswiederholrate abhängigen Grenzgeschwindigkeit kann man die Geschwindigkeit nicht mehr eindeutig zuordnen. Diesen Effekt nennt man Alias-Effekt.
Bei der farbkodierten Doppler-Sonografie wird für einen großen Bereich eines konventionellen Ultraschallbildes (Color-Window) die örtliche Doppler-Frequenz (= mittlere Flussgeschwindigkeit) und deren Schwankungsbreite bestimmt. Damit möchte man die Turbulenz der Strömung abschätzen. Aufgrund der statistischen Bewegungen der Streuteilchen ist die Schwankungsbreite der Fließgeschwindigkeit jedoch stets größer als die Turbulenz.
Das Ergebnis wird in Falschfarben auf dem B-Bild überlagert, also in Farbtönen von rot und blau für verschiedene Blutgeschwindigkeit und grün für Turbulenz. Hierbei steht üblicherweise die Farbe Rot für Bewegung auf den Schallkopf zu, während mit blauen Farbtönen Flüsse weg von der Sonde codiert werden. Bereiche der Geschwindigkeit 0 werden durch die Elektronik unterdrückt.
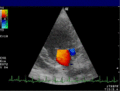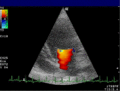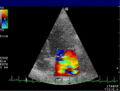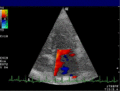
Anwendung des Doppler-Verfahrens bei einer Herzuntersuchung: Mitralklappeninsuffizienz
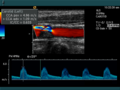
Farb-Doppler und PW-Doppler. Innerhalb der Stenose ist wegen der hohen Flussgeschwindigkeit und des resultierenden Alias-Effekts die Geschwindigkeit in Blau kodiert.

Gewebe-Doppler im Myokard
Eine spezielle Anwendung ist der Gewebe-Doppler (auch Tissue-Doppler), bei dem nicht die Blutflussgeschwindigkeiten, sondern die Geschwindigkeit des Gewebes, insbesondere des Myokards gemessen und dargestellt werden. Gegenüber den herkömmlichen Doppler-Verfahren treten wesentlich geringere Frequenzverschiebungen auf, und daher erfordert diese Untersuchungsmethode besondere Gerätemodifikationen. Eine Anwendung des Gewebe-Dopplers sind Strain (Elastizität) und Strain Rate (Elastizitäts-Rate) Imaging: hier wird die Kontraktilität einzelner Gewebeabschnitte des Herzmuskels gemessen, womit man hofft, bessere Aussagen zur regionalen Wandbewegung machen zu können.[4]
Weitere Techniken |
Fortschritte der digitalen Signalverarbeitung mit gesteigerter Rechenleistung eröffneten den Ultraschallgeräten neue Anwendungen. Mittels digitaler Schallwellencodierung ist es möglich, Umgebungsrauschen von der zur Bilderzeugung eingesetzten Schallwelle eindeutig abzugrenzen und damit die Auflösung zu verbessern. Auf ähnlichen Effekten wie die 3D-Sonografie beruhende Verfahren erlauben das Generieren von Panoramabildern.
Es kam zur Entwicklung weiterer Doppler-Verfahren. Der amplituden-codierte Doppler (Powerd-Doppler) erfasst nicht die Flussgeschwindigkeit, sondern die Menge der bewegten Teilchen und erlaubt somit die Detektion wesentlich langsamerer Flüsse, als es mittels der klassischen Doppler-Verfahren möglich ist.
Der Einsatz von sonografischen Kontrastmitteln (Kontrastmittelverstärkter Ultraschall) oder die Darstellung von Blutflüssen im B-Mode verfeinern die Möglichkeiten der Gefäßdiagnostik. Speziell den Kontrastmitteln wird eine steigende Bedeutung zugemessen, da mit ihrer Hilfe Aussagen über die Dignität (Gut- oder Bösartigkeit) von Gewebeneubildungen getroffen werden können.
Die B-Bild-Darstellung konnte Ende der 1990er Jahre noch einmal in kontrast- und räumlicher Auflösung mit Tissue Harmonic Imaging (THI) verbessert werden. Dieses Verfahren ist bei heutigen kommerziellen Ultraschallsystemen Standard.
Bildfehler |

Gb: Gallenblase;
LS: lateral shadowing;
SA: distale Schallauslöschung hinter dem stark reflektierenden Zwerchfell;
SV: distale Schallverstärkung

Rv: Reverberationen

Kometenschweifartefakt (Ks) hinter einer Dünndarmschlinge
Bei der Bilderzeugung mittels Ultraschall kann es zu Artefakten (Bildfehlern) kommen, die nicht durchweg als störend gelten, sondern auch zusätzliche Gewebe- bzw. Materialinformationen liefern können.
Ein sehr charakteristisches Artefakt ist das Speckle-Rauschen, das durch Interferenz der Schallwellen entsteht. Es ist die Ursache für die markanten, sich auf kurzer Distanz abwechselnden hellen und dunklen Flecken in Ultraschallbildern.
Ein häufiges Artefakt ist die Abschattung (distale Schallauslöschung) hinter stark reflektierenden Objekten mit einer vom übrigen Gewebe stark abweichenden Impedanz wie Knochen, Luft oder Konkrementen (Ablagerungen). Bei nahezu senkrechtem Schalleinfall gibt es ein starkes Echo, bei schrägem Einfall nicht.
Eine distale Schallverstärkung ist ein übermäßig hell dargestelltes Gewebe hinter (distal) einer Struktur, die wenig dämpft. Allgemein wird, um die Dämpfung des Gewebes auszugleichen und zum Beispiel Lebergewebe über die gesamte Tiefe homogen darzustellen, mit Hilfe der time gain compensation oder auch depth gain compensation, tiefer liegende Signale zunehmend verstärkt. Zum Beispiel bei einer Gallenblase in der Leber ist das Lebergewebe deutlich heller als das restliche Lebergewebe, weil Galle weniger dämpft als Lebergewebe, aber das Gewebe hinter der Gallenblase mit dem gleichen Verstärkungsfaktor aufgehellt wird wie das umliegende Gewebe.
Bei kreisförmig geschnittenen Objekten können die Randstrahlen weggespiegelt werden; dem Bild fehlen dann die Randstrukturen und es kommt zu Abschattungen (engl.: lateral shadowing).
Bei stark reflektierenden Grenzflächen kann es zu Mehrfachreflexionen (Kometenschweifartefakt, auch Ring-Down-Phänomen) beziehungsweise zu Spiegelartefakten in Form von virtuellen Bildern von vor der Grenzfläche befindlichen Objekten kommen.
Objekte können hinter Gebieten mit abweichender Schallgeschwindigkeit verschoben erscheinen.
Am Rand flüssigkeitsgefüllter Organe erzeugt ein wenig fokussierter Impuls beim Auftreffen auf eine schräg verlaufende Grenzfläche Echos mit geringer Stärke und unscharfer Kontur. Vor allem in flüssigkeitsgefüllten Hohlorganen wie Harn- und Gallenblase können durch dieses Schichtdickenartefakt in Wirklichkeit nicht vorhandene Strukturen vorgetäuscht werden.
Ungenügende Ankopplung des Schallkopfes an die Hautoberfläche verursacht das Auftreten mehrerer Echos im gleichen Abstand, ohne dass ein auswertbares Bild entsteht (Reverberationen).
Sicherheitsaspekte |
Die Anwendung von Ultraschall ist eine sichere Methode für die Bildgebung. Als mögliche Schadensquellen für Mensch und Tier kommen die Wärmeerzeugung und Kavitation in Betracht.
Kavitation |
Als Kavitation (lat.: cavis, -is = die Höhle) bezeichnet man den Effekt, dass in der Unterdruckphase einer Schallwelle im Gewebe Hohlräume bzw. Gasbläschen entstehen, die in der Druckphase kollabieren und eine Gewebsschädigung verursachen können. Das ist derselbe Effekt, der in einem Ultraschallreinigungsgerät genutzt wird. Je höher die Ultraschallfrequenz ist, desto höhere Spitzendrücke werden vom Gewebe (bzw. von Flüssigkeiten) toleriert. Verwendet man die diagnostisch interessanten Frequenzen zwischen 2 und 20 MHz, darf zur Vermeidung von Kavitation in reinem entgastem Wasser der negative Schalldruck maximal 15 MPa betragen. Das Gewebe selbst enthält jedoch sogenannte „Kavitationskeime“, die die Bildung von Kavitationsblasen begünstigen, sodass Kavitation im Gewebe schon bei deutlich geringeren negativen Schalldrücken auftreten kann. Besonders häufig tritt Kavitation an Übergängen zwischen Medien (Materialien) mit großem Unterschied in der akustischen Impedanz. Solche Übergänge finden sich im Körper vor allem zwischen Weichgewebe und Knochen bzw. Weichgewebe und luftgefüllten Bereichen (Lunge, Darm). Man geht zurzeit davon aus, dass Kavitation im menschlichen Körper nicht unter 4 MPa negativen Spitzendruck auftritt. Kavitation kann auch durch Ultraschallkontrastmittel begünstigt werden, daher kann beim Einsatz solcher Kontrastmittel Kavitation auch schon unterhalb von 4 MPa auftreten.
Wärme |
Das Maß an erzeugter Wärme ist abhängig von der absorbierten Schallintensität; Wärmeabfuhr geschieht durch Blutströmung und Wärmeleitung. Für gesundes Gewebe ist selbst eine längerfristige Temperaturerhöhung von 1,5 °C unbedenklich. Dennoch sollte die Einwirkzeit begrenzt werden. Die einzelnen Verfahren im Detail:
Im B-Mode ist die eingebrachte Leistung pro Schallpuls 1 bis 10 mW und verteilt sich auf ein großes Volumen innerhalb einer Beschallungszeit (für den Einzelpuls) von unter 1 µs und einer Impulswiederholfrequenz deutlich unter 5 kHz.
Im (T)M-Mode wird statt eines Volumens eine Linie des Gewebes mit einer Impulswiederholrate von etwa 1 kHz durchschallt.
Das Puls-Dopplerverfahren erfolgt auch statisch, allerdings ist die Impulsfolgefrequenz mit bis zu 30 kHz viel höher und eine Überwärmung nicht mehr auszuschließen. Daher muss hierbei Impulsfolge und Sendeschalldruck in angemessenem Verhältnis gewählt werden und die Untersuchungszeit so kurz wie möglich sein.
Beim Continuous-Wave Doppler-Verfahren wird ständig eine Leistung von etwa 10 bis 100 mW in einem kleinen Volumen appliziert. Wie beim Puls-Doppler sollte die Untersuchungszeit so kurz wie möglich sein.
Allgemeines |
Durch die in der Klinik verwendeten Intensitäten bzw. durch sorgfältige Anpassung und Optimierung der Parameter (Sendeleistung, Impulsfolge, Applikationsdauer) ist eine Gesundheitsgefährdung unwahrscheinlich. Eine Untersuchung der Food and Drug Administration (FDA) der USA ergab folgenden Sicherheitsbereich: Eine Schädigung tritt nicht auf, solange die applizierte Intensität Jdisplaystyle J


International gibt es eine Sicherheitsnorm für Ultraschallgeräte (IEC 60601-2-37), die allerdings keine Grenzwerte nennt und lediglich die Offenlegung bestimmter akustischer Parameter eines Gerätes fordert, sofern eines der folgenden Kriterien erfüllt ist: negativer Schalldruck über 1 MPa, räumlich maximale, zeitlich gemittelte Intensität über 100 mW/cm², Intensität bezogen auf die Fläche des Schallwandlers von über 20 mW/cm². Der Hersteller muss ein Risikomanagement erstellen. Darin muss der Hersteller eine Grenze der sicherheitsrelevanten Parameter (Mechanischer Index MI und Thermischer Index TI) für sein Gerät angeben und im Hinblick auf die Anwendung rechtfertigen.
Darüber hinaus warnt die FDA vor unnötigen pränatalen Untersuchungen für das Erstellen von Bildern oder Videos als „Andenken“ ohne jede medizinische Indikation (Begründung), wie sie von manchen unseriösen Geschäftemachern und Ärzten angeboten werden. Zwar gibt es keine gesicherten Hinweise auf biologische Effekte, hervorgerufen durch eine Einwirkung gegenwärtig verwendeter Diagnostikinstrumente, allerdings ist es möglich, dass solche Effekte in der Zukunft erkannt werden.
Physikalische Grundlagen |
Sonografie als bildgebendes Verfahren in der medizinischen Diagnostik beruht darauf, dass sich Schallwellen in unterschiedlichen Medien verschieden schnell ausbreiten. Sie werden an Grenzflächen unterschiedlicher Wellenimpedanz teilweise reflektiert, ein anderer Teil breitet sich – oft bei geänderter Richtung – weiter aus. Vereinfachend kann die Untersuchung beispielsweise eines Menschen mit der einer Flüssigkeit beschrieben werden, in der sich wichtige materialabhängige Größen in menschlichen Geweben und Wasser sprunghaft ändern (s. Tabelle 1). Mit steigender Differenz der Wellenimpedanz vergrößert sich auch der reflektierte Anteil. In weichen Materialien können sich aufgrund der geringen Scherviskosität nur unpolarisierbare longitudinale Wellen ausbreiten.
| Medium | Schallgeschwindigkeit cdisplaystyle c  in m/s | Wellenimpedanz Zdisplaystyle Z  in kg/(m²s) | Dichte ρdisplaystyle rho  in kg/m³ |
|---|---|---|---|
Luft | 340 | 410 | 1,2 |
| Fett/Wasser/Hirn/Muskeln | 1500 | 1,5·106 | 1000 |
| Knochen (kompakt) | 3600 | 6·106 | 1700 |
Bei einer diagnostischen sonografischen Untersuchung sind folgende Werte für Schallparameter üblich:
- Ultraschallfrequenz: f=1…40MHzdisplaystyle f=1ldots 40,mathrm MHz
- mittlere Schallintensität: J=100mWcm2displaystyle J=100,tfrac mathrm mW mathrm cm ^2
- mittlere Druckänderung (gegenüber Normaldruck): Δp<0,6⋅105Padisplaystyle Delta p<0,6cdot 10^5,mathrm Pa
.
Schallphänomene |
Mit der Schallausbreitung gehen wie in der Wellenoptik die Phänomene Reflexion, Brechung, Beugung, Streuung und Absorption einher. Reflektierte und gestreute Schallwellen werden als Echos von der Ultraschallsonde registriert, und durch die Auswertung derer Stärken und Laufzeiten ist eine Abbildung des durchstrahlten Objektes möglich.
Reflexion |
Für die Reflexion unter senkrechtem Einfall des Schalls an glatten Grenzflächen zwischen Gebieten mit unterschiedlicher Impedanz Zdisplaystyle Z

- RAmpl=Z2−Z1Z2+Z1displaystyle R_mathrm Ampl =frac Z_2-Z_1Z_2+Z_1
Für das Verhältnis der Schallintensitäten gilt:
- RInt=(Z2−Z1Z2+Z1)2displaystyle R_mathrm Int =left(frac Z_2-Z_1Z_2+Z_1right)^2
Je größer der Impedanzunterschied, desto stärker die Reflexion. Im Vergleich zur Optik verhält sich hier die Impedanz analog zum Brechungsindex. Um beim Übergang von schallerzeugender Sonde zum Untersuchungsobjekt möglichst wenig Intensität durch Reflexion zu verlieren, soll Rdisplaystyle R

Streuung |
Bei rauen und nicht senkrecht zum Ultraschallstrahl angeordneten Grenzflächen kann trotzdem ein Echo registriert werden, da ein diffuser Strahlungskegel zurückgestreut wird. Die Streuung an Inhomogenitäten erzeugt für eine Gewebestruktur charakteristische Signale aus Gebieten zwischen Grenzflächen, wodurch Gewebetypen unterscheidbar sind. Je nach Durchmesser adisplaystyle a




Absorption |
Eine Absorption von Schallfeldern erfolgt aufgrund Streuung, innerer Reibung, nicht isentroper Kompression sowie Anregung innerer Freiheitsgrade (Molekülrotation, -schwingung) des schalltragenden Mediums. Die Energie wird dabei in Wärme umgesetzt. Die Schwächung erfolgt exponentiell mit zunehmender Entfernung xdisplaystyle x


Frequenz fdisplaystyle f  in MHz in MHz | maximale Untersuchungstiefe xdisplaystyle x in cm | Untersuchungsgebiet |
|---|---|---|
| 1 | 50 | |
| 2–3,5 | 25–15 | Fötus, Leber, Herz, Veterinärmedizin (Großtiere) |
| 3,5 | 15 | Niere, Veterinärmedizin (große Hunde) |
| 5 | 10 | Gehirn, Veterinärmedizin (mittelgroße Hunde) |
| 7,5 | 7 | Schilddrüse, Brustdrüse, oberflächliche Gefäße, Veterinärmedizin (kleine Hunde, Katzen) |
| 8–9 | 6 | Prostata (endoskopisch) |
| 10 | 5 | |
| 11–12 | 4–3 | Pankreas (intraoperativ) |
| 7,5–15 | 7–2 | Brustdiagnostik |
| 20 | 1,2 | |
| 21–24 | 1,1–0,9 | Auge, Haut |
| 40 | 0,6 | Haut, Gefäße |
Erzeugung und Nachweis von Ultraschall |
Die Erzeugung von Ultraschall und auch der Nachweis zurückkommender Echos finden zumeist elektromechanisch in einem Wandler statt, der Teil der Sonde ist, und basiert auf dem piezoelektrischen Effekt: In einem piezoelektrischen Material wird durch mechanische Spannung eine elektrische Polarisation, eine Aufladung der Oberfläche und damit eine elektrische Spannung erzeugt. Bei Vibration des Materials wird Wechselspannung erzeugt (Nachweis der Schallschwingungen). Umgekehrt schwingen diese Kristalle mechanisch, wenn man eine elektrische Wechselspannung anlegt (Erzeugung von Schallschwingungen). Verwendung finden vor allem Keramiken wie Bariumtitanat, Bleititanat, -zirkonat, -metaniobat. Diese werden polarisiert durch starke Erhitzung und anschließende Abkühlung unter Anlegen einer elektrischen Spannung.
Das Schallfeld eines kreisförmigen Ultraschallwandlers |

Schallfeld eines unfokussierten 4-MHz-Ultraschallwandlers mit der Nahfeldlänge N = 67 mm, angezeigt werden die Amplituden der Schalldrücke
Die Ausbreitung und Intensitätsverteilung der abgestrahlten durch Beugung begrenzten Schallwellen lässt sich in guter Näherung aus der Annahme des Huygensschen Prinzips herleiten, dass jeder Punkt der Wandleroberfläche eine Kugelwelle aussendet.
Das Ergebnis kann man abhängig von der Entfernung zdisplaystyle z
Der Nahbereich ist geprägt durch starke Interferenzen, die eine sehr inhomogene Intensitätsverteilung zur Folge haben.
Im Fernbereich bildet sich eine kontinuierlich aufweitende Strahlkeule.
Im Fokalbereich (zwischen Nah- und Fernbereich) ist die Intensität gebündelt und nimmt senkrecht zur Strahlachse ab. Mit Ddisplaystyle D

- z=(1…2)⋅D2−λ24λ,displaystyle z=left(1ldots 2right)cdot frac D^2-lambda ^24lambda ,
wobei der Ausdruck N=(D2−λ2)/(4λ)displaystyle N=(D^2-lambda ^2)/(4lambda )

Das Beispiel zeigt das durch Simulationsrechnungen ermittelte Schallfeld eines unfokussierten Ultraschallwandlers mit einer Frequenz f = 4 MHz, einem Durchmesser des Schwingers von 10 mm für Wasser mit einer Schallgeschwindigkeit von c = 1500 m/s. Angezeigt werden die Amplituden der Schalldrücke. Die Nahfeldlänge beträgt N = 67 mm. Man erkennt darin die starke Zerklüftung des Schallfeldes im Nahbereich und das allmähliche Abklingen des Schalldrucks im Fernbereich.[7][8]
Das Schallfeld eines fokussierten Ultraschallwandlers |
Schallfeld desselben Ultraschallwandlers (4 MHz, N = 67 mm) mit einer spherisch gekrümmten Wandleroberfläche mit dem Krümmungsradius R = 30 mm. Angezeigt werden die Schalldrücke.
Der Ultraschall kann durch die Krümmung der Wandleroberfläche, durch Verwenden einer akustischen Linse oder – bei entsprechend ausgelegten Mehrkanalwandlern – durch eine geeignete zeitversetzte Ansteuerung der einzelnen Elemente fokussiert werden.
Grundsätzlich erfolgt die Fokussierung dabei auf einen Punkt innerhalb der Nahfeldlänge, der typischerweise im Bereich z=(0,2…0,8)⋅Ndisplaystyle z=(0,2ldots 0,8)cdot N
Das Beispiel zeigt das durch Simulationsrechnungen ermittelte Schallfeld desselben Ultraschallwandlers wie im vorherigen Abschnitt. Die Fokussierung kommt durch Krümmung der Wandleroberfläche (Krümmungsradius R = 30 mm) zustande. Angezeigt werden die Amplituden der Schalldrücke.
Auflösungsvermögen |
Das örtliche Auflösungsvermögen ist ein Maß für die Fähigkeit eines Messgeräts, nahe beieinanderliegende Objekte getrennt wahrnehmen zu können. Man unterscheidet das Auflösungsvermögen in Richtung der Strahlachse (axial) und senkrecht zur Achse (lateral).
Lateral |

Sende-Empfangsfeld des unfokussierten Ultraschallwandlers (4 MHz, N = 67 mm) im Fokus bei N = 67 mm.
Messtechnisch bestimmt man die laterale Auflösung, indem ein punktförmiges Objekt innerhalb des Fokalbereichs vor dem Schallkopf senkrecht zur Schallausbreitungsrichtung vorbeigeschoben und die Amplitude des Echosignals als Funktion des Ortes (also des Abstandes von der Strahlachse) aufgetragen wird. Die Breite ddisplaystyle d


Rechnerisch ergibt sich die laterale Auflösung aus der 6-dB-Grenze des sogenannten Sende-Empfangs-Feldes, das heißt, den Quadraten der für die jeweilige Messanordnung berechneten Schalldrücke. Die Quadrierung der Schalldrücke berücksichtigt, dass die Richtwirkung des Ultraschallwandlers sowohl beim Senden, als auch beim Empfang wirksam ist.
Das Beispiel zeigt einen x/y-Schnitt des zuvor beschriebenen Ultraschallwandlers (4 MHz, Schwingerdurchmesser 10 mm, Nahfeldlänge N = 67 mm) im Fokus bei z = 67 mm. Die 6-dB-Grenze ist gelb eingefärbt und weist eine Breite von ungefähr 2,8 mm auf.
Axial |
Zwei in Schallrichtung hintereinanderliegende Gewebeschichten können gerade noch getrennt wahrgenommen werden, wenn von den Grenzflächen zwei unterscheidbare Echos ausgehen. Hauptsächlich entscheidend für das axiale Auflösungsvermögen sind:
- die Schallfrequenz und
- die Dauer und Form des Anregesignals
Bei Anwendung der einfachen Echomethode verbessert sich das Auflösungsvermögen mit steigender Frequenz, und sie verschlechtert sich mit der Länge des Anregesignals. Typischerweise verwendet man breitbandige Ultraschallwandler und regt sie mit einem kurzen rechteckförmigen Puls an. Dabei sind Länge und Form des Anregesignals meist nicht variabel und die sich daraus ergebenden Echosignale von einer Gewebeschicht weisen etwa 2 oder 3 Schwingungen mit einer allmählich steigenden und fallenden Einhüllenden auf. Die Empfangssignale sind nur dann unterscheidbar, wenn sie sich zeitlich nicht überschneiden. Aufgrund des doppelten Schallweges im Puls-Echo-Verfahren (hin und zurück), benötigt man bei einem Sendesignal mit einer Länge von 3 Schwingungen somit einen Mindestabstand der Schichten von 1,5 Ultraschall-Wellenlängen. Bei einem Signal mit einer Frequenz von 5 MHz ergibt sich so beispielsweise eine Wellenlänge von λ=0,3mmdisplaystyle lambda =0,3,mathrm mm 
Bei Verwendung von speziell codierten breitbandigen Anregesignalen ist die zeitliche Dauer des Anregesignals nicht alleine ausschlaggebend, da die Echosignale durch geeignete mathematische Methoden sehr stark verkürzt und dadurch getrennt werden können. Durch das Pulskompressionsverfahren mit beispielsweise Chirpsignalen wird die Korrelationsfunktion aus Sende- und Empfangssignal ausgewertet. Auf diese Weise erreicht man trotz verlängerter Signaldauer erheblich bessere Signalauflösung und Rauschfreiheit als mit der einfachen Echomethode. Es ist derzeit hauptsächlich in der Forschung im Einsatz.[9]
Übliche Werte |
Typisch erreichbare Ortsauflösungen je nach Sendefrequenz sind:
| Frequenz: | 2–15 MHz |
| Wellenlänge (in Muskulatur): | 0,78–0,1 mm |
| Eindringtiefe (einfach): | 12–1,6 cm |
| Ortsauflösung lateral: | 3,0–0,4 mm |
| Ortsauflösung axial: | 0,8–0,15 mm |
Der Ultraschall-Markt |
Ultraschallgeräte kosten je nach Ausstattung (zum Beispiel Anzahl der Sonden und Zusatzsoftware) und Qualität als Neugerät zwischen 3.000 Euro und 250.000 Euro (Stand Januar 2009). Die Größe variiert zwischen Smartphone-Größe über Laptop-Format und -Größe zu 200 kg schweren Systemen, die einem schmalen Schreibtisch mit PC auf Rollen ähneln. Einfache Dopplergeräte zum Anhören des Herzschlages von Föten gibt es bereits ab etwa 50 Euro.
Das Gesamtvolumen des Umsatzes „in Ultraschall“ beträgt weltweit ca. vier Milliarden Dollar (2004) und wächst jährlich um etwa drei bis vier Prozent.[10] Die bedeutsamsten Anbieter sind GE, Philips, Siemens und Toshiba mit Marktanteilen um jeweils zwanzig Prozent. Am stärksten wachsen die Segmente mit 3D- und 4D-Darstellung. Außerdem wächst der Markt für Geräte, die in der Hand gehalten werden können stark; hier ist Sonosite der Marktführer.[11] Es werden etwa genauso viele Systeme in die Segmente Kardiologie und Radiologie abgesetzt wie in die Geburtshilfe.
Siehe auch |
- Spezielle Techniken: Intravaskulärer Ultraschall · Endobronchialer Ultraschall
- Anwendungsgebiete: Pränataldiagnostik· Echokardiografie · Feinultraschall · Endosonografie · Mammasonografie
- Ähnliche Verfahren: Elastografie · Optische Kohärenztomografie · Neutronentomografie · Laserscanning
Literatur |
- Cornelius Borck: Ultraschall-Diagnostik. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4, S. 1428 f.
Olaf Dössel: Bildgebende Verfahren in der Medizin. Von der Technik zur medizinischen Anwendung. 1. Auflage. Springer, Berlin u. a. 2000, ISBN 3-540-66014-3.- H. Fendel (Hrsg.): Praenatale Dopplerdiagnostik. Dopplersonographie und Morphologie der uterofetoplazentaren Gefässversorgung bei Risikoschwangerschaften. Steinkopff, Darmstadt 1992, ISBN 3-7985-0919-0.
- T. Grau (Hrsg.): Ultraschall in der Anästhesie und Intensivmedizin. Lehrbuch der Ultraschalldiagnostik. Deutscher Ärzte-Verlag, Köln 2007, ISBN 978-3-7691-1200-9.
- Heinz Morneburg (Hrsg.): Bildgebende Systeme für die medizinische Diagnostik. Röntgendiagnostik und Angiographie, Computertomographie, Nuklearmedizin, Magnetresonanztomographie, Sonographie, Integrierte Informationssysteme. 3. wesentlich überarbeitete und erweiterte Auflage. Publicis MCD Verlag, Erlangen 1995, ISBN 3-89578-002-2.
- Carl-Detlev Reimers, Hartmut Gaulrapp, Henrich Kele (Hrsg.): Sonographie der Muskeln, Sehnen und Nerven. Untersuchungstechnik und Befundinterpretation. 2. überarbeitete und erweiterte Auflage. Deutscher Ärzte-Verlag, Köln 2004, ISBN 3-7691-1188-5.
- Günter Schmidt (Hrsg.): Ultraschall-Kursbuch. Nach den Richtlinien der DEGUM und der KBV. 4. vollständig überarbeitete und erweiterte Auflage. Thieme Verlag, Stuttgart u. a. 2004, ISBN 3-13-119104-X.
- Günter Schmidt (Hrsg.): Sonographische Differenzialdiagnose. Lehratlas zur systematischen Bildanalyse mit über 2500 Befundbeispielen. Thieme Verlag, Stuttgart u. a. 2002, ISBN 3-13-126141-2.
- Bernhard Widder, Michael Görtler: Doppler- und Duplexsonographie der hirnversorgenden Gefäße. 6. erweiterte und vollständig bearbeitete Auflage. Springer, Berlin u. a. 2004, ISBN 3-540-02236-8.
Klaus Vetter: Dopplersonographie in der Schwangerschaft. Weinheim u. a., Basel u. a. 1991, ISBN 3-527-15472-8.
Weblinks |
- Internistischer Sonografieatlas des Albertinen-Krankenhaus Hamburg
- Mannheim-Ludwigshafener Ultraschallkolloquium: Links zu Ultraschallwebseiten und Fallsammlungen, umfangreiche Fallsammlung
- Deutsche Gesellschaft für Ultraschall in der Medizin (DEGUM)
Überblick und moderne Entwicklungen (in Englisch)
Einzelnachweise |
↑ Steiner/Schneider, Dopplersonographie in Geburtshilfe und Gynäkologie, 3. Auflage, ISBN 3642209386, S. 72 f.
↑ Kubale R et al. (2002) Farbkodierte Duplexsonographie: interdisziplinärer vaskulärer Ultraschall ISBN 3-13-128651-2
↑ David H. Evans, W. Norman McDicken: Doppler Ultrasound – Physics, Instrumental, and Clinical Applications. 2. Auflage, Wiley, 2000, ISBN 978-0-471-97001-9.
↑ George R. Sutherland, Liv Hatle, Piet Claus, Jan D’Hooge, Bart H. Bijnens: Doppler Myocardial Imaging: A Textbook. BSWK bvba, 2006, ISBN 90-810592-1-1.
↑ http://www.uniklinik-duesseldorf.de/fileadmin/Datenpool/einrichtungen/klinik_und_poliklinik_fuer_strahlentherapie_und_radioonkologie_id30/dateien/ultraschall_eine_einfuhrung.pdf Seite 17.
↑ http://www.uniklinik-duesseldorf.de/fileadmin/Datenpool/einrichtungen/klinik_und_poliklinik_fuer_strahlentherapie_und_radioonkologie_id30/dateien/ultraschall_eine_einfuhrung.pdf Seite 18.
↑ Elfgard Kühnicke: Elastische Wellen in geschichteten Festkörpersystemen – Modellierungen mit Hilfe von Integraltransformationsmethoden – Simulationsrechnungen für Ultraschallanwendungen. TIMUG e. V., ISBN 3-934244-01-7.
↑ J. Krautkrämer, H. Krautkrämer: Werkstoffprüfung mit Ultraschall. Springer, Berlin, ISBN 978-3-540-15754-0.
↑ T. Misaridis, J.A. Jensen: Use of modulated excitation signals in medical ultrasound. (PartI-III), 2005, IEEE Transactions on Ultrasonics, Ferroelectrics and Frequency Control (PDF (Memento des Originals vom 3. Juli 2010 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.ieee-uffc.org)
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.ieee-uffc.org)
↑ PR leap, 27. Oktober 2006, zugegriffen am 28. Januar 2009
↑ Frost&Sullivan Research Services, 26. Oktober 2004, zugegriffen am 28. Januar 2009
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |








