Strahlentherapie
Strahlentherapie (auch Radiotherapie) ist die medizinische Anwendung von ionisierender Strahlung auf den Menschen und auf Tiere, um Krankheiten zu heilen oder deren Fortschreiten zu verzögern. Die Strahlung kann aus Geräten oder aus radioaktiven Präparaten stammen. Fachgebiete für diese spezielle Anwendung elektromagnetischer Wellen heißen Strahlenheilkunde und Radioonkologie.
Als Strahlen werden vorwiegend Gammastrahlung, Röntgenstrahlung und Elektronenstrahlung verwendet. In den letzten Jahren wurden auch Anlagen zur Behandlung mit Neutronen, Protonen und schweren Ionen (häufig Kohlenstoff-Ionen) errichtet. Nicht ionisierende Strahlen wie zum Beispiel Mikrowellen- und Wärmestrahlen, Licht- und UV-Therapie sowie die Behandlung mit Ultraschallwellen werden der Strahlentherapie zugeordnet.
Strahlentherapie umfasst die Behandlung von gut- und bösartigen Erkrankungen. Sie wird von Fachärzten für Radiologie oder für Strahlentherapie unter Mitwirkung von medizinisch-technischen Assistenten und spezialisierten Medizinphysikern ausgeübt. Ihre Tätigkeit unterliegt der Strahlenschutzverordnung und nachgeordneten Normen. Der eigentlichen Therapie geht ein komplexer Planungsprozess – die Bestrahlungsplanung – voraus. Umfangreiche organisatorische und technische Qualitätssicherungsmaßnahmen sorgen dafür, dass Bestrahlungsfehler weitgehend ausgeschlossen werden können.
Nach den in Deutschland gültigen Weiterbildungsordnungen umfasst das Gebiet Strahlentherapie auch die medikamentösen und physikalischen Verfahren zur Radiosensibilisierung und Verstärkung der Strahlenwirkung am Tumor (Radioimmuntherapie und Radiochemotherapie), unter Berücksichtigung von Schutzmaßnahmen der gesunden Gewebe.
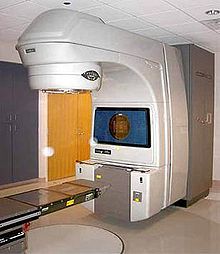
Medizinischer Linearbeschleuniger

Ein medizinischer Linearbeschleuniger sowjetischer Bauart in der Radiologischen Klinik der Friedrich-Schiller-Universität Jena, DDR im Februar 1985
Inhaltsverzeichnis
1 Teletherapie
1.1 CT-gestützte Planung
1.2 Simulation, Verifikation, IGRT
1.3 Konformale Bestrahlungstechnik
1.4 Intensitätsmodulation
1.5 Wirkungsmechanismus
1.6 Fraktionierung
1.7 Akzelerierung
1.8 Radiochemotherapie
1.9 Hyperthermie
1.10 Radiochirurgie
2 Partikeltherapie
3 Brachytherapie
4 Therapie mit Radionukliden
5 Nachsorge
6 Geschichte der Strahlentherapie
7 Anwendung gegen gutartige Erkrankungen
8 Anwendung gegen Krebs
9 Sachaufklärung gegen die Angst
10 Nebenwirkungen der Strahlenbehandlung
10.1 Frühreaktionen am Normalgewebe
10.2 Spätreaktionen
10.3 Kumulative Folgen
10.4 Stochastische Strahlenschäden
11 Facharzt für Strahlentherapie
12 Strahlentherapie in der Tiermedizin
13 Siehe auch
14 Einzelnachweise
15 Literatur
16 Weblinks
Teletherapie |
Die Strahlentherapie kennt Methoden zur Teletherapie (von griechisch tele ‚fern‘), wobei die Strahlung von außen auf den Körper des Patienten einwirkt, und die Brachytherapie (von griech. brachys ‚nah‘, ‚kurz‘), bei der die Strahlenquelle sich im oder direkt am Körper befindet.
Bei der Teletherapie wird die erforderliche Strahlung normalerweise in Linearbeschleunigern erzeugt, die sowohl Elektronen- als auch Röntgenbremsstrahlung mit hohen Energien bis 23 MeV (= Mega-Elektronenvolt; für Photonen wird manchmal auch die zahlengleiche, theoretische Beschleunigungsspannung in MV angegeben) bereitstellen können.
Elektronen haben fast die gleiche biologische Wirksamkeit wie die Photonen der Röntgenstrahlung, jedoch eine andere Tiefendosisverteilung im Gewebe. Während die im Gewebe deponierte Dosis einer Photonenstrahlung mit zunehmender Tiefe langsam in Form einer Exponentialkurve abnimmt, haben Elektronen wegen ihrer elektrischen Ladung eine begrenzte mittlere Reichweite (Faustregel: Betrag in MeV/2 in cm). Sie eignen sich für oberflächliche Zielvolumina vor Risikoorganen, etwa für die Brustwand vor Herz und Lunge.
Das Dosismaximum einer Bestrahlung mit hochenergetischen Photonen oder Elektronen liegt nicht auf der Hautoberfläche, sondern einige Millimeter tiefer. Die Ursache dieses Dosisaufbaus ist, dass der eigentliche Dosisbeitrag überwiegend erst durch Sekundärelektronen stattfindet, die im durchstrahlten Material ausgelöst werden. So wird die Haut besser geschützt als bei Strahlung geringerer Energie. Ist dies nicht erwünscht, etwa bei der Behandlung eines Hauttumors, wird eine Schicht aus Plexiglas oder gewebeäquivalentem Weichplastik (Bolusmaterial) auf die Haut aufgelegt.
Optimal für den Beschuss tieferliegender Organe sind energiereiche Protonen, die das Gewebe davor kaum und dahinter nur minimal schädigen.
CT-gestützte Planung |

Isodosenplan einer Bestrahlung der Halsregion
Eine wesentliche Voraussetzung für die erfolgreiche Strahlentherapie ist die vollständige Erfassung der Tumormasse mit möglichst wenig umgebendem Normalgewebe. Früher wurden die Einstrahlrichtungen und Feldgrenzen nach klinischer Erfahrung mithilfe von Röntgenbildern festgelegt. Heute wird fast immer mithilfe einer Computertomographie, gelegentlich nach Bildfusion mit MR- oder PET-Daten, ein dreidimensionales Modell der Bestrahlungsregion im Planungsrechner erstellt und für die Bestrahlungsplanung zugrundegelegt. Die Tumormasse und Risikoorgane werden meist manuell oder neuerdings auch halbautomatisch segmentiert. Die Strahleigenschaften des Beschleunigers sind dem System aufgrund von aufwendigen Messreihen bekannt. Zur Berechnung der erwarteten Dosisverteilung einer bestimmten Feldanordnung dienen Summations- und Nadelstrahl-Algorithmen und Monte-Carlo-Simulationen. Moderne Planungssysteme können umgekehrt aus einer gegebenen Dosisverteilung mögliche Feldanordnungen berechnen (inverse Planung).
Simulation, Verifikation, IGRT |
Die vom Medizinphysiker berechnete und vom Arzt ausgewählte Feldanordnung wird auf den Patienten übertragen. Dies geschieht entweder an einer dem Bestrahlungsgerät ähnlich dimensionierten Röntgendurchleuchtungsanlage (Therapiesimulator), oder neuerdings vermehrt am CT-Gerät. Bei der „virtuellen Simulation“ im CT werden nacheinander die Mittel- und Eckpunkte der Einzelfelder eingestellt und auf der Haut markiert. Am CT muss zu diesem Zweck ein geeignetes Laser-Koordinatensystem installiert sein. Die Feldränder werden mit individuell gegossenen Bleiblöcken geformt, die für Photonen ca. 5 cm dick sein müssen, für Elektronen 0,5 cm (siehe Abschirmung).

Clinac mit ausgefahrener IGRT-Vorrichtung quer zum Hauptstrahlengang
Bei der echten Bestrahlung werden die Lagerung des Patienten und die Feldparameter aus der Simulation mithilfe von Lichtvisieren und Lasermarkierungen millimetergenau reproduziert. Die Einstellungsgenauigkeit wird überprüft, indem ein Röntgenfilm (oder ein elektronischer Bilddetektor; sog. portal imaging system) hinter dem Patienten in den Strahlenweg gebracht wird. Das so erzeugte Bild wird mit den Aufnahmen aus der Simulation verglichen (Verifikation). So kann die Position des bestrahlten Zielvolumens selbst auf dem Bestrahlungstisch nochmals überprüft und nötigenfalls korrigiert werden (sog. image-guided radiotherapy, IGRT). Mit der „harten“ Photonenstrahlung lassen sich allerdings nur relativ kontrastarme Bilder erzeugen. Darum ist in manchen Beschleunigern zusätzlich eine Röntgendurchleuchtung integriert, mit der auch das Weichteilgewebe der Umgebung in der Deutlichkeit eines Röntgenbilds dargestellt werden kann. Moderne Geräte können auch Schnittbilder erzeugen, die sich direkt mit den CT-Bildern der Simulation vergleichen lassen.
Konformale Bestrahlungstechnik |
Standardverfahren der Teletherapie ist heute die 3-dimensional konformale Strahlentherapie, bei dem die zu behandelnde Körperregion in den Überschneidungsbereich der Achsen mehrerer Strahlen platziert wird, die aus unterschiedlichen Richtungen einwirken (Isozentrum), und durch individuell geformte Bleiblenden oder Anpassung der beschleunigerseitig vorhandenen Blenden des Multileafkollimators (MLC) der Zielkontur angepasst sind. Die Felder können noch mit Keilfiltern moduliert werden, um unterschiedliche durchstrahlte Gewebsdicken auszugleichen. Wenn die Einstrahlrichtungen aller Teilfelder auf einer gemeinsamen Ebene liegen (typischerweise eine Schnittebene quer zur Patientenlängsachse), spricht man von koplanarer, sonst von non-koplanarer Planung. Moderne Behandlungspläne nutzen mehrere Volumendefinitionen (Zielvolumen erster und zweiter Ordnung), die unterschiedlich intensiv bestrahlt werden. Diese Techniken sind international genormt, zum Beispiel im ICRU-Report 50.
Intensitätsmodulation |

Intensitätsmatrix eines Bestrahlungsfeldes der IMRT

Ein Patient wird auf eine Tomotherapie vorbereitet
Eine Weiterentwicklung der CT-gestützten, konformalen, 3D-geplanten Bestrahlung ist die die intensitätsmodulierte Strahlentherapie (IMRT). IMRT-Verfahren wurden in den 90er Jahren fast nur an Universitätskliniken angewendet, werden in der BRD aber inzwischen in den meisten strahlentherapeutischen Zentren angeboten. Bei der IMRT wird nicht nur die Feldbegrenzung, sondern auch die Strahlendosis innerhalb der Feldfläche moduliert. Die wissenschaftliche Bezeichnung dafür ist Fluenzmodulation. Die IMRT erlaubt sehr kompliziert geformte, selbst konkav begrenzte Zielvolumina und eignet sich daher für Tumoren in unmittelbarer Nähe von sensiblen Risikoorganen. Eine IMRT ist sehr zeitaufwendig zu berechnen, auszuführen und zu kontrollieren. Die klinischen Vorteile der IMRT gegenüber einer konformalen 3D-geplanten Bestrahlung sind bei manchen Indikationen so groß, dass es fast ein Kunstfehler ist, die IMRT nicht anzuwenden. Z.B. ermöglichte die IMRT des Prostatakarzinoms aufgrund geringerer Nebenwirkungen eine Dosissteigerung, die wiederum die Heilungsrate verbesserte[1].
In der Anfangszeit erfolgte die Fluenzmodulation durch metallische Ausgleichskörper (Kompensatoren) im Strahlenweg mit individuell gegossenem Profil für jedes Feld. Dieses technisch und zeitlich aufwendige Verfahren wird außerhalb von Forschungseinrichtungen in der BRD nicht mehr benutzt. In der BRD werden gegenwärtig folgende Verfahren zur Erzeugung fluenzmodulierter Strahlungsfelder verwendet[2]:
- statische IMRT
- dynamische IMRT
- VMAT
- Tomotherapie
Bei allen Verfahren erfolgt die Feldformung durch einen Multileaf-Kollimator (MLC). Die zungenförmigen Metallabsorber des MLCs können über Schrittmotoren bewegt werden, so dass fast jede Feldform ferngesteuert erzeugt werden kann. Die MLCs haben die früher verwendeten, schweren, individuell gegossenen Bleiabsorber weitgehend verdrängt.
Bei der statischen IMRT werden aus jeder geplanten Einstrahlrichtung mehrere, unterschiedlich geformte Felder nacheinander abgestrahlt. Nach jedem Segment (= Einzelfeld aus einer Richtung) wird die Bestrahlung unterbrochen. Im Englischen wird der Begriff "step and shoot" gebraucht. Dieses Verfahren ist relativ langsam.
Bei der dynamischen IMRT wird bei jeder Einstrahlrichtung die Feldform bei laufender Bestrahlung mit dem Multileafkollimator kontinuierlich verändert Die dynamische IMRT ist schneller als die statische IMRT. Im Englischen wird die dynamische IMRT "sliding window" genannt.
Ein weiteres Verfahren der IMRT ist die Volumetric Intensity Modulated Arc Therapy (VMAT). Hierbei wird das Strahlenfeld während der Rotation der Strahlenquelle um den Patienten moduliert; der Multileaf-Kollimator wird bei eingeschalteter Strahlung kontinuierlich angepasst. Neben der Feldform können auch Rotationsgeschwindigkeit, Kollimatorwinkel und Dosisleistung variiert werden. Das Verfahren erlaubt einen hohen Modulierungsgrad der Strahlung. Die Gesamtapplikationszeit ist erheblich kürzer als bei der IMRT.[3] Bei Beschleunigern der Firma Varian heißt das Verfahren RapidArc.
Als Tomotherapie wird ein radiologisches Verfahren bezeichnet, bei dem ähnlich wie in einem Computertomografen die Strahlen von allen Seiten auf die zu bestrahlende Stelle gerichtet werden können. Zu diesem Zweck rotiert die Strahlenquelle in einem entsprechenden Ring (siehe Abbildung), während gleichzeitig der Patient gleichmäßig mit dem Tischvorschub durch das Thomotherapiegerät bewegt wird. Das Strahlenfeld ist sehr schmal und wird nur in seiner Länge variiert. Der Therapiestrahl wird auch als Fächerstrahl bezeichnet. Die gewünschte geometrische Präzision der Bestrahlung wird dadurch erreicht, dass ein mit dem Tomotherapie-Gerät kombinierter Computertomograf verwendet wird, um die genaue Lokalisation eines zu bestrahlenden Tumors regelmäßig neu zu bestimmen. Das Ergebnis ist eine hoch konformale Bestrahlung, die den anderen IMRT-Verfahren nicht nachsteht und Vorteile bei sehr langen Zielvolumina (z. B. Neuroachse) hat. Die mit der Bestrahlung von Tumorpatienten oft einhergehenden Nebenwirkungen sollen dadurch verringert werden. Die Behandlungsmethode wurde 2003 erstmals klinisch eingesetzt. Sie basiert auf Entwicklungen an der Universität Wisconsin (USA). Hauptanwendungsgebiete der Tomotherapie sind bösartige Neubildungen wie Prostatakrebs, Lungenkrebs, Brustkrebs und Kopf-Hals-Karzinome.
Wirkungsmechanismus |
Die Wirkung der Bestrahlung beruht auf der Energieübertragung auf das durchstrahlte Gewebe in Streuprozessen. Dabei sind direkte Treffer an für das Zellwachstum wesentlichen Biomolekülen weniger bedeutsam als die Ionisierung von Wassermolekülen.

Dosis-Wirkungs-Beziehung
Die entstehenden freien Radikale sind hochtoxisch und reagieren chemisch mit Zellbestandteilen. Die daraus resultierenden Schäden an der Erbsubstanz der Tumorzellen, insbesondere DNA-Doppelstrangbrüche, sind für die zerstörende Wirkung verantwortlich. Schäden, die die Reparaturfähigkeit der Tumorzelle überschreiten, hindern sie an der Vermehrung (Mitose) oder bringen sie sogar unmittelbar zur Apoptose. Da zur Wirkung mehrere Treffer in enger räumlicher und zeitlicher Nähe eintreten müssen, ist die Dosis-Wirkungs-Beziehung einer beliebigen Gewebsreaktion immer sigmoid (S-förmig) mit zuerst langsamem, dann schnellerem Anstieg und zuletzt Sättigung. Die Normalgewebe zeigen etwas geringere Wirkung als der Tumor, das heißt ihre S-Kurve liegt weiter rechts im höheren Dosisbereich. Die optimale Strahlendosis erreicht im Durchschnitt >90 % Tumorvernichtung bei <5 % schweren Nebenwirkungen.
Fraktionierung |

Fraktionierungseffekt von Photonen- und Neutronenstrahlen an einer Zellkultur
Tumorzellen haben in der Regel eine schlechtere Reparaturfähigkeit für DNA-Schäden als normale Zellen. Diesen Unterschied nutzt man aus, indem die Dosisleistung verringert (Protrahierung, wird heute kaum noch verwendet) oder die Gesamtdosis auf tägliche kleine Einzeldosen (1,8–2,5 Gy) verteilt (Fraktionierung) wird. Damit verringert sich die mit der gleichen Dosis abgetötete Zellzahl. Die maximal tolerierte Gesamtdosis des Normalgewebes (ca. 10 Gy bei kleinem Volumen) kann so auf ein Vielfaches gesteigert werden; nur fraktionierte Schemata erreichen tumorizide Herddosen bis 80 Gy. Die biologische Wirkung verschiedener Fraktionierungsschemata kann mit dem linearquadratischen Modell berechnet werden.
Neutronenstrahlen haben keinen wesentlichen Fraktionierungseffekt, die aufgeteilte Dosis ist ebenso stark wirksam wie die einzeitig eingestrahlte. Das liegt an ihrer sehr hohen Energieabgabe auf kurzer Laufstrecke; ein einziges Teilchen kann eine Vielzahl von Doppelstrangbrüchen innerhalb eines Zellkernes verursachen und damit die Reparaturkapazität der Zelle überschreiten. Man hat versucht, Neutronenstrahlen gegen relativ strahlenunempfindliche Tumoren wie etwa der Prostata oder der Speicheldrüsen einzusetzen. Geladene schwere Teilchen scheinen aber noch bessere physikalische Eigenschaften zu haben (s. u.).
Akzelerierung |
Da der Tumor während der Behandlung weiter wächst und radioresistente Zellklone selektioniert, ist die Heilungschance umso größer, je kürzer die Gesamtbehandlungszeit (2–7 Wochen) ist. Das gilt vor allem für schnellwachsende Tumorarten, etwa Rachenkrebs. Man kann die Gesamtbehandlungszeit verkürzen, indem man zwei oder sogar drei Fraktionen pro Tag einstrahlt (Akzelerierung). Dies erhöht jedoch die Nebenwirkungen am Normalgewebe erheblich.
Radiochemotherapie |
Strahlentherapie und Chemotherapie verstärken sich gegenseitig in der Wirkung. Viele potentiell heilbare Tumoren bei Patienten in gutem Allgemeinzustand werden deshalb mit beiden Verfahren simultan (gleichzeitig) oder sequentiell behandelt, was als Radiochemotherapie bezeichnet wird. Für Lungenkrebs, Darmkrebs, Gebärmutterhalskrebs[4][5] und Tumoren der Halsregion wurde nachgewiesen, dass die simultane Radiochemotherapie anderen Therapievarianten überlegen ist. Wichtige Zytostatika für den Strahlentherapeuten sind 5-Fluoruracil (5-FU) und Cisplatin. Allerdings sind die kombinierten Schemata auch mit stärkeren Nebenwirkungen belastet.
Substanzen, die die Resistenz der Normalgewebe erhöhen sollen, nennt man Radioprotektoren. Amifostin ist der erste und bisher einzige[6] zugelassene Radioprotektor.[7]
Hyperthermie |
Schlecht durchblutete, sauerstoffarme Tumoren sind meist strahlenresistent. Umgekehrt kann man beobachten, dass solche Gewebe gegenüber therapeutischer Überwärmung besonders empfindlich sind. Die Kombination der Strahlentherapie mit Hyperthermie hat also theoretische Vorteile. Kleinere Studien bestätigen bessere Heilungschancen bei verschiedenen Tumoren, zum Beispiel schwarzem Hautkrebs, Sarkomen, und rezidiviertem Gebärmutterhalskrebs. Die Daten sind jedoch noch unsicher, auch wegen der unübersichtlichen Vielfalt von Hyperthermietechniken, sodass die Methode noch keine allgemeine Anerkennung gefunden hat.
Radiochirurgie |

Individuell angefertigte Bestrahlungsmaske
Will man eine extrem kurze Behandlungszeit und trotzdem abtötende Dosen am Tumor, so ist das in ausgewählten Fällen mit der Radiochirurgie (Syn. stereotaktische Radiochirurgie) möglich. Diese Methode ist praktisch nur bei kleineren Hirntumoren möglich. Der Kopf des Patienten wird während der Behandlung mit einem stereotaktischen Ring fest verschraubt. Neuere Geräte fixieren den Patienten schmerzfrei mit einer enganliegenden Maske. Geeignete Spezialanlagen für die Radiochirurgie sind das Gamma-Knife und vollautomatisierte Linearbeschleuniger, die Industrierobotern ähneln, wie beispielsweise Cyberknife oder Novalis. Die Dosis beträgt 12–18 Gy.
Partikeltherapie |

Elektronen mit 4 MeV dringen in Gewebe nur 1 cm tief ein, erzeugen aber zusätzlich weitreichende Bremsstrahlung. Photonen mit 20 MeV schädigen ab 3 cm und tiefer. Protonen mit 150 MeV schädigen überwiegend räumlich begrenzt in 12 cm Tiefe. „Intensität“ bedeutet hier Dosis pro Weglängeneinheit
Im Hinblick auf Schonung des umliegenden Gewebes ergibt eine Bestrahlung mit Protonen oder noch schwereren Teilchen einen im Vergleich zu Photonen oft günstigeren Tiefendosis-Verlauf. Anlagen zur Bestrahlung mit Protonen, Neutronen sowie Schwerionen sind in Betrieb. Leider sind die Erwerbs- und Betriebskosten solcher Anlagen sehr viel höher als bei konventionellen Elektronen-Linearbeschleunigern, bei denen der Elektronenstrahl oder die mit ihm erzeugte Röntgenstrahlung verwendet wird.
Anlagen mit Neutronen- und Protonenquellen zur Partikeltherapie sind in einigen großen Forschungszentren verfügbar, in Villigen (Schweiz) und in Deutschland in Berlin (Helmholtz-Zentrum Berlin für Materialien und Energie, ehemals Hahn-Meitner-Institut, nur Augenbestrahlung). Seit März 2009 gibt es eine klinische Einrichtung zur Protonenbestrahlung, das Rinecker Proton Therapy Center (RPTC), in München. In Essen wurden seit Mai 2013 rund 1.000 Patienten am Westdeutschen Protonentherapiezentrum Essen (WPE) behandelt[8]. Im April 2014 wurde das WPE vollständig durch das Universitätsklinikum Essen[9] übernommen. Seit dem Frühjahr 2016 sind alle 4 Behandlungsräume in Betrieb. Drei Räume sind mit sogenannten Gantries ausgestattet, bei denen die Strahlführung um 360 Grad gedreht werden kann, der vierte Behandlungsraum ist mit einer horizontalen Strahlführung (Fixed-Beam-Line) und einem Augentherapieplatz ausgerüstet.[10] Hier können Tumoren mit der pencil beam scanning-Technologie bekämpft werden. Zukünftig wollen die Ärzte dort bis zu 1.000 Patienten pro Jahr behandeln.[11]
Anlagen zur Schwerionentherapie gibt es in drei Zentren in Japan (Chiba, Gunda und Kyōto). In Deutschland waren im Rahmen eines Pilotprojektes von 1997 bis 2008 Patienten bei der GSI in Darmstadt behandelt worden. In der Nachfolge ging das Heidelberger Ionenstrahl-Therapiezentrum (HIT) am Universitätsklinikum Heidelberg 2009 in Betrieb. Dort können Patienten sowohl mit Protonen als auch Kohlenstoffionen in der Rasterscanning-Technik behandelt werden. In Kiel und Marburg waren Zentren für Partikeltherapie mit Protonen und Kohlenstoffionen im Bau. Das Zentrum in Kiel sollte seinen Betrieb 2012 aufnehmen. Die Rhön-Klinikum AG als Betreiberin des Universitätsklinikums Gießen/Marburg und das Uniklinikum Kiel hatten sich 2011 aus dem Aufbau und Betrieb von Ionenstrahl-Therapieanlagen verabschiedet.[12] Im September 2014 einigten sich das Universitätsklinikum Heidelberg mit dem Land Hessen, der Rhön Klinikum AG, den Universitäten Marburg und Heidelberg, dem Universitätsklinikum Marburg sowie der Siemens AG vertraglich schließlich doch auf die Inbetriebnahme der Partikeltherapieanlage am Standort Marburg.[13] Am Marburger Ionenstrahl-Therapiezentrum (MIT) wurden am 27. Oktober 2015 die ersten beiden Patienten mit Protonenstrahlen behandelt.[14]
Schwere elektrisch geladene Teilchen, d. h. Schwerionen und Protonen, zeigen im Vergleich zur konventionell eingesetzten Photonenstrahlung eine viel dichtere Energieabgabe an das durchstrahlte Gewebe (Linearer Energietransfer LET), was als Hoch-LET-Effekt bezeichnet wird. Infolgedessen sind die verursachten Schäden an der DNA gravierender, ihre Reparatur schwieriger für die Zelle und der therapeutische Effekt ist größer. Hoch-LET-Strahlung hat noch weitere biologische Vorteile: Sie wirkt auch bei schlecht durchbluteten, langsam wachsenden Tumoren, die sich gegenüber konventioneller Bestrahlung als sehr resistent erweisen. Dieser Effekt ist aber bei Schwerionen lokal begrenzt und kann dem Tumor angepasst werden, während er sich bei Neutronen auf der gesamten Länge der Teilchenbahn zeigt, also unerwünschterweise auch das vor dem Tumor liegende gesunde Gewebe betrifft. Bei Neutronen wird die Strahlbegrenzung außerdem mit wachsender Tiefe immer stärker verwischt, und es kommt zu einem exponentiellen Abfall der Strahlendosis. Aufgrund dieses Tiefendosisverlaufs ist die Dosis im gesunden Gewebe vor dem Tumor höher als im Tumor selbst. Nach Neutronenstrahlung wurden erhöhte Nebenwirkungsraten beschrieben.
Schwerionen und Protonen haben – im Gegensatz zu Neutronen – eine definierte, scharf begrenzte Reichweite, so dass Gewebe hinter dem zu bestrahlenden Tumor vollständig geschont werden kann. Sie geben ihre Energie an die Materie zunächst nur geringfügig und erst nach fast vollständiger Abbremsung konzentriert ab (sogenannter Bragg-Peak); dies erlaubt es, durch geeignete Wahl der Ionenenergie auch vor dem Tumor gelegenes Gewebe zu schonen (siehe auch Teilchenstrahlung). Protonen- und Schwerionenstrahlung ist bei Tumoren indiziert, bei denen mit der konventionellen Strahlentherapie keine zufriedenstellenden Erfolge erzielt werden. Derzeit wird in klinischen Studien untersucht, welche Krebspatienten von dieser Therapie profitieren. Eine Protonenbestrahlung ist bei kompliziert lokalisierten, also nahe strahlensensiblem Normalgewebe gelegenen Tumoren indiziert. Der Einsatz von Schwerionen bietet sich an, wenn der Tumor darüber hinaus gegenüber konventioneller Strahlung vergleichsweise resistent ist. Schwerionen vereinen also die Vorteile der höheren biologischen Effektivität und der größeren physikalische Selektivität bei gleichzeitig geringer Nebenwirkungsrate.
Eine Protonen- und Schwerionentherapie ist zurzeit ausgewählten Krebserkrankungen vorbehalten, darunter beispielsweise Chordome und Chondrosarkome der Schädelbasis und des Beckens, (adenoidzystische) Speicheldrüsenkarzinome, Prostatakarzinome u. a.
Brachytherapie |
Moderne Verfahren der Brachytherapie umfassen Afterloadingverfahren und Implantationen. Afterloading (eng. für „Nachladen“) nennt man ein Verfahren, bei dem eine kleine radioaktive Strahlenquelle (Ir-192) ferngesteuert in eine Körperöffnung verbracht und nach vorausberechneter Zeit wieder entfernt wird (Dekorporation). Diese Methode erlaubt einerseits die direkte Bestrahlung zum Beispiel der Gebärmutter und andererseits bestmöglichen Strahlenschutz für das behandelnde Personal. Gegenüber den älteren Radiumstrahlern hat Iridium-192 allerdings den strahlenbiologischen Nachteil der hohen Dosisleistung, die nur begrenzt durch Fraktionieren der Bestrahlung ausgeglichen werden kann. Der Dosisabstand zwischen erwünschten und unerwünschten Effekten ist kleiner als beim Radium. Afterloading ist besonders für weibliche Unterleibstumoren geeignet. Es gibt zahlreiche Trägersysteme für andere Zielorgane wie etwa die Luft- und Speiseröhren; auch Hohlnadeln zum Spicken solider Gewebe (interstitielles Afterloading) sind verfügbar. Afterloading-Therapie wird in Strahlenschutzbauwerken ähnlich denen für die Teletherapie durchgeführt. Enge Zusammenarbeit mit den Gynäkologen, Internisten und Chirurgen ist zum Erfolg der handwerklich komplizierten Methode unabdingbar.
Bei den Implantationsverfahren werden kleine, gekapselte Strahlungsquellen (eng. seeds) mit kurzer Halbwertszeit in den Körper verbracht und verbleiben dort dauerhaft, während ihre Aktivität abklingt. Eine typische Anwendung sind Seed-Implantationen der Prostata mit Iod-125. (59 Tage Halbwertszeit). I-125 zerfällt mit einer Halbwertszeit von 59,4 Tagen durch Elektroneneinfang zu Tellur-125. Dabei werden Gammastrahlen einer Energie von 23 bis 27 KeV frei, die überwiegend in nächster Nähe der Seeds absorbiert werden und an der Körperoberfläche kaum noch messbar sind.[15] Es ist daher kein spezieller Operationssaal und keine Quarantäne erforderlich.
Therapie mit Radionukliden |
Offene Radionuklide fallen prinzipiell in das Fachgebiet der Nuklearmedizin, die mit der Radiojodtherapie und ähnlichen Methoden der Radionuklidtherapie große Erfahrung hat. Einzelne Substanzen ergänzen jedoch auch in der Hand des Strahlentherapeuten das Therapiespektrum; beispielsweise wirkt eine Injektion mit radioaktivem Strontium-89 effektiv gegen die Schmerzen einer fortgeschrittenen Knochenmetastasierung. Noch nicht abschließend bewertet ist der Ansatz, tumorspezifische Antikörper mit radioaktiven Substanzen zu koppeln, die Betastrahlung im Nahbereich emittieren (Radioimmuntherapie). Allerdings hat die Anwendung von radioaktiv markiertem Ibritumomab (monoklonarer chimärer Antikörper gegen CD20) mit einem Yttrium-Isotop (Ibritumomab-Tiuxetan) bereits Einzug in die klinische Praxis erhalten.
Nachsorge |
Strahlentherapeuten sind dazu verpflichtet, sich nach Abschluss einer Strahlentherapie über die eingetretenen Wirkungen und Nebenwirkungen zu informieren. Gewöhnlich wird der Patient zu Nachsorgeuntersuchungen einbestellt, etwa nach sechs Wochen und nochmals nach einem Jahr. Prinzipiell sollte der Strahlentherapeut den Patienten über mehrere Jahre wegen der oft erst spät eintretenden Nebenwirkungen nachsorgen.
Unabhängig davon werden nach der Behandlung einer Krebserkrankung routinemäßige Nachsorgeuntersuchungen beim Hausarzt, Frauenarzt usw. empfohlen.
Geschichte der Strahlentherapie |
Am 28. Dezember 1895 versandte Wilhelm Conrad Röntgen die erste seiner drei Mitteilungen über eine neue Art von Strahlen. Die Ärzteschaft nahm die Entdeckung begeistert auf; noch 1896 wurden in ganz Europa und in den USA Hunderte von Röntgenapparaten in Betrieb genommen. Der erste Hersteller, der Röntgens Idee aufgegriffen hatte, die Erlanger Vereinigten Physikalisch-Mechanischen Werkstätten Reiniger, Gebbert & Schall, ging 1925 im Siemens-Konzern auf. In den USA wurde General Electric zum größten einschlägigen Hersteller.
Schnell wurde erkannt, dass die Strahlen Hautentzündungen und Haarausfall verursachen. Erst in den Folgejahren gelangten die schwerwiegenden Strahlenschäden bis hin zum Tod vieler Röntgenärzte in das Bewusstsein der Anwender. Erst 1904 schrieb der Bostoner Zahnarzt William Herbert Rollins das weltweit erste Buch über Strahlenfolgen. Zunächst war man über die Wirkung erfreut und versuchte sie therapeutisch zu nutzen.
Am 6. März 1897 veröffentlichte der Österreicher Leopold Freund in der Wiener Medizinischen Wochenschrift einen Artikel mit dem Titel Ein mit Röntgen-Strahlen behandelter Fall von Naevus pigmentosus piliferus (Tierfell-Muttermal). Die Behandlung eines fünfjährigen Mädchens war der erste beschriebene Fall, bei dem Röntgenstrahlen zu Heilzwecken angewendet wurden. Im Jahr 1903 gab Freund das erste Lehrbuch der Strahlentherapie heraus: Grundriss der gesamten Radiotherapie für praktische Ärzte. Wichtige Pioniere der Strahlentherapie waren Friedrich Dessauer und Hans Holfelder.
Neben diagnostischen Geräten entwickelten die Ingenieure bald spezielle Therapieröhren und -generatoren. Ein wichtiger Meilenstein war die von William David Coolidge erfundene Hochleistungsröhre. In Erlangen wurde 1925 eine Anlage vorgestellt, die es erlaubte, die Röntgenröhre um den Patienten herumzuschwenken und das Ziel aus mehreren Richtungen zu bestrahlen. Diese sogenannte „Kreuzfeuerbestrahlung“ war der Vorläufer der modernen Konformaltherapie. Nach dem Zweiten Weltkrieg ersetzten radioaktive Strahler mit höherer Leistung und Maximalenergie fast alle Therapieröhren. Nur für die Behandlung von oberflächlichen Hauttumoren werden gelegentlich noch Röntgenstrahler eingesetzt (Grenzstrahlen- und Weichstrahlengeräte).

Radiumhemmet 1917
Fast gleichzeitig mit der Entwicklung von Röntgenstrahlern war die Entdeckung und technische Nutzung der natürlichen Radioaktivität einhergegangen, aufbauend auf der Entdeckung des Radiums durch Marie und Pierre Curie 1898. Die von Radium abgegebene Strahlung ist viel energiereicher als Röntgenstrahlung. Der Gammastrahlenanteil kann dabei sehr tief in den Körper eindringen. Radium lässt sich zudem industriell herstellen und konfektionieren. Die Radiumstrahler benötigen keine Stromquelle und zerfallen extrem langsam. Sie eignen sich besonders zur Brachytherapie in Körperhöhlen. Daher richteten viele Kliniken nach dem Muster des 1910 in Stockholm gegründeten Radiumhemmet Strahlentherapieeinheiten ein (Stockholmer Methode), vorzugsweise innerhalb der Gynäkologie. 1949 wurde in einem Demonstrationsfilm die an der Frauenklinik der Universität Göttingen entwickelte „Göttinger Methode“ vorgestellt, eine Kleinraumbestrahlung mit Radium im „Siemens-Körperhöhlenrohr“. Sie gilt als einer der Vorläufer des heute üblichen Afterloadings.

Strahlentherapie 1970 in der DDR
1941 wurde unter Leitung von Enrico Fermi der erste Atomreaktor der Welt kritisch und hielt eine Kettenreaktion selbständig aufrecht. In diesen Reaktoren ist die Herstellung von künstlichen Radionukliden möglich, die gegenüber dem Radium geeignetere physikalische Eigenschaften haben, vor allem eine höhere Dosisleistung pro Masseeinheit. In der Teletherapie wurden die Röntgenröhren bis 1960 überall durch Strahlenkanonen mit Quellen aus radioaktivem Cobalt-60 oder Cäsium-137 ersetzt. Wegen der damit verbundenen Strahlenschutzprobleme gab es schon 1954 die ersten Versuche, elektrisch betriebene Teilchenbeschleuniger für die Therapie zu modifizieren, angefangen mit einem großen Van-de-Graaff-Beschleuniger in Berkeley, später vorwiegend mit beweglich konstruierten Betatrons. Diese Anlagen waren jedoch sehr teuer und aufwendig bei schwacher Dosisleistung, sodass die Telecurie-Geräte (sogenannte Kobaltkanonen) in den meisten Kliniken weiter genutzt wurden. Trotz strenger Strahlenschutzvorschriften für den Erwerb, die Nutzung und die Entsorgung kam es in der Vergangenheit zu folgenschweren Unfällen durch die illegale Entsorgung ausgedienter Strahlenquellen. Wegen ihrer überlegenen technischen Eigenschaften und im Hinblick auf solche Risiken ersetzten schließlich die Linearbeschleuniger, die seit ca. 1970 verfügbar waren, die Cobalt- und Cäsiumstrahler in der Routinetherapie. In Deutschland sind Anfang der 2000er Jahre die letzten Kobaltkanonen außer Betrieb gegangen. Linearbeschleuniger dürfen im Gegensatz zu den Röntgen- und Telecurieanlagen nur in Anwesenheit eines Medizinphysikers benutzt werden, dem auch die technische Qualitätskontrolle obliegt. Die effektiv auf den Patienten abgegebene Dosis ist sehr vielen Einflüssen und Fehlermöglichkeiten unterworfen, sodass nur durch peinlich genaue Überwachung der Maschine schwere Unfälle wie der Therac-25-Fehler 1986 in Zukunft verhindert werden können. Neue Verfahren wie die IMRT ergeben weitere Risiken, die in ihrer Komplexität und Unanschaulichkeit begründet sind.
In der Brachytherapie wurde Radium noch lange weiterverwendet. Dabei mussten die etwa bohnengroßen Radiumpatronen von Hand eingesetzt, nach 1 bis 2 Tagen wieder entfernt und gereinigt werden. Wegen der hohen Strahlenbelastung des Personals und der Gefahr versehentlicher Kontaminationen wurden die europäischen Radiumstationen bis 1990 nach und nach durch Afterloading-Systeme ersetzt, die mit dem künstlichen und intensiv strahlenden Isotop Iridium-192 bestückt sind.
Anwendung gegen gutartige Erkrankungen |
Zahlreiche chronisch-entzündliche und degenerative Erkrankungen wie Fersensporn, Tennisellbogen, Schulterschmerzen, Arthrosen der verschiedenen Gelenke, Wirbelkörperhämangiome, Induratio penis plastica und andere können strahlentherapeutisch behandelt werden. Diese sogenannte Reizbestrahlung weit unterhalb der gewebeabtötenden Dosis ist mit Ausnahme des stochastischen Risikos nebenwirkungsfrei. Die Ansprechraten liegen bei 50 bis 70 %. Die verwendeten Gesamtdosen liegen im Bereich von 1 bis 20 Gray und sind somit deutlich niedriger als die Dosen, die bei der Therapie von Krebserkrankungen (20 bis 80 Gy) verwendet werden müssen. Niedrigdosierte Strahlung reduziert die Aktivität von Leukozyten und Vorläuferzellen des Bindegewebes und mindert die Ausschüttung von Zytokinen; damit hemmt sie akute und chronische Entzündungsprozesse. Direkte Hemmung der Schmerzrezeptoren wird ebenfalls vermutet. Insbesondere Schulterschmerzen und Fersensporne sind der Strahlentherapie gut zugänglich. In Deutschland werden pro Jahr etwa 37.000 Patienten mit nicht-malignen Erkrankungen bestrahlt, mit steigender Tendenz[16].
Anwendung gegen Krebs |

Bestrahlungsplan für einen Brustkrebs
Bösartige Tumoren werden sehr häufig bestrahlt; oft auch in Kombination mit anderen Behandlungsverfahren wie Operation und Chemotherapie. Etwa jeder zweite Krebskranke erhält eine oder mehrere Strahlentherapien. Etwa gleich häufig sind palliative Bestrahlungen, etwa von Knochenmetastasen, und kurative, das heißt in Heilungsabsicht angewendete Behandlungsserien. Neoadjuvante Strahlentherapie soll den Tumor für eine nachfolgende Operation verkleinern; adjuvante Strahlentherapie soll das Ergebnis einer vorangegangenen Operation sichern und mikroskopische Tumornester vernichten. Im onkologischen "Log cell kill"-Konzept kann von einer korrekt dosierten Strahlentherapie eine Reduktion der Tumorzellzahl um den Faktor 1000 erwartet werden.
In allen Fällen nutzt man die Tatsache aus, dass Tumorgewebe strahlenempfindlicher ist als das umgebende Normalgewebe. Die Heilwirkung erfordert Fraktionierung und hohe Gesamtdosen von 20 bis 80 Gray je nach Art des Tumors. Symptomlindernde Behandlungen für unheilbare Patienten können kürzer sein; beispielsweise können Knochenherde mit einmalig 8 Gy schmerzlindernd behandelt werden.

Maske zur optimalen Positionierung des Kopfes während der Bestrahlung
Mit modernen Strahlentherapieverfahren können heutzutage in stadienabhängiger Kombination mit Chirurgie und Chemotherapie eine Vielzahl von Tumorerkrankungen auch in fortgeschrittenen Stadien geheilt werden. Über alle Tumorarten und Stadien gemittelt beträgt die Heilungschance ca. 50 %. Einzelne Tumoren wie etwa der Morbus Hodgkin und das Seminom des Hodens können fast immer geheilt werden. Die häufigsten Indikationen zur Strahlentherapie sind zurzeit Prostatakrebs, adjuvant nach Brustkrebs-Operationen, und beim Enddarmkrebs. Ein besonderer Vorteil ist die Tatsache, dass durch eine Strahlentherapie ein Organerhalt auch in Situationen, bei denen die Erkrankung schon relativ weit fortgeschritten ist, möglich bleibt. Hier kann vor allem die Kombination von Strahlentherapie mit einer Chemotherapie bei Krebserkrankungen des Kehlkopfs angeführt werden. Bei anderen Tumorerkrankungen, wie zum Beispiel dem Prostatakarzinom, stehen operative Verfahren und strahlentherapeutische Verfahren zueinander in Konkurrenz und können vergleichbare Ergebnisse haben. Hier ist es die Aufgabe des beratenden Arztes, dem Patienten alle Vor- und Nachteile der jeweiligen Verfahren zu erläutern. Erstrebenswert sind in diesem Zusammenhang zertifizierte Tumorzentren, in denen alle Fachdisziplinen vertreten sind und die dem Patienten damit eine umfassende Beratung ermöglichen.
Einige Tumoren weisen jedoch eine nur geringe Strahlungsempfindlichkeit auf. Die Ursache hierfür ist ein Sauerstoffmangel (Hypoxie) im Tumorgewebe.[17] Verschiedene Therapiekonzepte versuchen mit Hilfe von sogenannten Radiosensitizern (Strahlungssensibilisatoren), die Strahlungsempfindlichkeit dieser Tumoren zu erhöhen.[18]
Sehr selten kann es zu einem abscopalen Effekt kommen, bei dem eine Tumorregression bis hin zur kompletten Remission auch an Stellen zu verzeichnen ist, die nicht bestrahlt wurden. Dieser Effekt wurde 1953 erstmals beschrieben und bisher nur in Einzelfällen berichtet, so bei Leukämie, Lymphom, Nierenzellkarzinom und malignem Melanom.[19]
Sachaufklärung gegen die Angst |
Der nach wie vor bestehenden Angst vor der Strahlentherapie setzt die Deutsche Krebshilfe Sachaufklärung mit der kostenfreien Informationsreihe Die Blauen Ratgeber entgegen. Dazu gehört ferner die erste DVD Strahlentherapie. Der Patienten-Informationsfilm aus der Reihe „Die blaue DVD“ wird von der Deutschen Krebshilfe kostenlos abgegeben und klärt auch darüber auf, dass die Strahlentherapie ein Standard in der modernen Krebsbehandlung ist.
Außerdem hält der Krebsinformationsdienst (KID) des Deutschen Krebsforschungszentrums (DKFZ) auf seiner Website, telefonisch oder via E-Mail zahlreiche Informationen rund um das Thema Krebserkrankungen und -therapien bereit, darunter auch ausführliche Informationen zum Thema "Strahlentherapie und Nuklearmedizin".
Nebenwirkungen der Strahlenbehandlung |
Frühreaktionen am Normalgewebe |
Einige Nebenwirkungen (Frühreaktionen) treten in Abhängigkeit von der Dosis, Eindringtiefe und Anzahl der applizierten Einzeldosen auf: Hautrötungen im Bestrahlungsfeld und Schleimhautentzündungen im Mund-Rachen-Bereich oder der Speiseröhre, wenn die Kopf-Hals-Region bestrahlt wird. Völlegefühl, Übelkeit oder Durchfälle sowie Blasenbeschwerden treten bei Bestrahlungen im Bauchbereich auf. Mit Haarausfall ist nur zu rechnen, wenn der Kopf bestrahlt wird.
Nebenreaktionen sind im Allgemeinen bezogen auf sogenannte Risikoorgane. Jedes Risikoorgan hat seine eigene Toleranzdosis (in Gray), ab der Nebenwirkungen zu erwarten sind. Diese Toleranzdosen dürfen nicht überschritten werden.
Diese Toleranzdosen ergeben sich aus der Strahlensensibilität des Gewebes, sowie dessen Regenerationsfähigkeit, und ob das gesamte Organ oder nur ein Teil bestrahlt wird. Seriell aufgebaute Organe wie der Dünndarm sind besonders kritisch, weil der Ausfall eines kleinen Teilsegments die Funktion des gesamten Organs gefährdet. Äußerst sensibel sind auch Gewebe mit streng hierarchischem Aufbau, die sich beständig aus einer kleinen Population teilungsfähiger Stammzellen regenerieren, beispielsweise Schleimhaut oder Knochenmark. Die Frühschäden werden nach der weltweit gültigen CTC-Klassifizierung (common toxicity criteria) quantifiziert.
Spätreaktionen |
Spätreaktionen nach mehr als drei Monaten beruhen auf Gefäßverengungen und Fibrosierung (Narbenbildung) im Bindegewebe. Häufig sind Verfärbungen der Haut, Verhärtungen im Unterhautfettgewebe, Mundtrockenheit (Xerostomie) durch Schädigung der Speicheldrüsen, Geschmacksverlust, Knochen- und Zahnschäden, Lungenfibrose, und andere. Bei Bestrahlungen im Beckenbereich ist mit Infertilität zu rechnen. Spätfolgen werden in die Schweregrade 0-5 der LENT-SOMA-Klassifizierung (late effects on normal tissues, in subjective, objective, management and analytic categories) eingeordnet. Zur Verminderung von Strahlenschäden an den Mundschleimhäuten können Strahlenschutzschienen eingesetzt werden.
Das Risiko einer koronaren Herzkrankheit ist nach einer Bestrahlung im Rahmen der Therapie eines Brustkrebses deutlich erhöht, abhängig von der auf das Herz einwirkenden genäherten Organ-Gesamtdosis um etwa 7,4 % pro Gray. Das Risiko steigt beginnend nach fünf Jahren bis über zwanzig Jahre kontinuierlich an, ohne dass ein Schwellenwert besteht und unabhängig von weiteren kardiologischen Risikofaktoren.[20]
Kumulative Folgen |
Während die frühen Strahlenreaktionen sich vollständig zurückbilden, bleiben die Spätreaktionen lebenslang erhalten. Vorbestrahlte Organe sind sehr empfindlich und neigen bei weiteren Dosiseinträgen zu schweren Nebenwirkungen bis hin zur Strahlennekrose beziehungsweise im Fall des Skelettsystems zur Osteoradionekrose. Strahlentherapeutische Faustregeln ermöglichen einige Jahre nach einer Behandlung eine Wiederholung mit reduzierter Dosis.
Stochastische Strahlenschäden |
Stochastische Strahlenrisiken treten nicht zwangsläufig auf und haben keine Dosis-Wirkungsbeziehung, sondern eine dosisabhängige Eintrittswahrscheinlichkeit. Im Gegensatz zu den nicht-stochastischen Nebenwirkungen gibt es keinen unteren Schwellenwert. Stochastische Risiken sind die Induktion bösartiger Tumoren, und die Keimzellschädigung mit der Gefahr von Missbildungen in den kommenden Generationen. Naturgemäß sind diese Risiken in hohem Maß alters- und zustandsabhängig. Sie sind in den Veröffentlichungen der ICRP und UNSCEAR tabelliert. Die Krebsinduktion innerhalb von 10 Jahren nach einer Strahlentherapie wird auf bis zu 2 % geschätzt (je nach Region und Volumen); dabei muss berücksichtigt werden, dass auch Chemotherapien karzinogene Potenz besitzen und dass die Krebserkrankung selbst das statistische Risiko für weitere Krebserkrankungen erhöht. Das Risiko für eine Keimbahnschädigung liegt in der ersten Kindgeneration bei ca. 1,4 %, bei 0,7 % in der zweiten, und kumulativ bei 0,7 % in allen weiteren Generationen. Hier sind synergistische mutagene Wirkungen der Zytostatika anzunehmen. Männern wird empfohlen, im ersten Jahr nach einer Strahlentherapie auf die Zeugung zu verzichten.
Facharzt für Strahlentherapie |
Infolge der technischen und prozeduralen Weiterentwicklung im Gebiet der Strahlentherapie wurde sie aus dem Gebiet der Radiologie ausgegliedert und ein neuer Facharzt geschaffen, unter Bestandschutz für die bereits tätigen Ärzte für Radiologie. Die Muster-Weiterbildungsordnung der deutschen Bundesärztekammer dient den rechtsverbindlichen Länderregelungen als Vorlage. Die aktuelle MWBO (zuletzt revidiert 2003) fordert für die Anerkennung als Facharzt für Strahlentherapie eine fünfjährige Weiterbildungszeit in gemäß § 5 zur Weiterbildung ermächtigten Abteilungen, von der ein Jahr im Stationsdienst abgeleistet werden muss, 6 Monate davon in einem beliebigen Gebiet. Früher war ein Jahr in der diagnostischen Radiologie vorgeschrieben; dies ist immer noch auf freiwilliger Basis anrechenbar. Die reine Zeit in der Strahlentherapie beträgt also 3 bis 4 Jahre.
Am 31. Dezember 2008 waren in Deutschland 1054 Strahlentherapeuten registriert, von denen 260 niedergelassen waren. 121 übten keine ärztliche Tätigkeit aus[21]. Die DEGRO (Deutsche Gesellschaft für Radioonkologie) bildet ihre nationale Fachgesellschaft. Einschlägige Normierungen und Forschungen werden von der Arbeitsgemeinschaft für Radioonkologie in der DKG organisiert. Internationale Fachgesellschaften der Strahlentherapeuten sind die ESTRO und die EORTC.
Strahlentherapie in der Tiermedizin |
In der Veterinärmedizin kann die Strahlentherapie ebenso eingesetzt werden wie beim Menschen, dennoch spielt sie hier nur eine untergeordnete Rolle. Grund ist vor allem die mangelnde Verfügbarkeit entsprechender Einrichtungen. Die Nutzung humanmedizinischer Zentren für Strahlentherapie ist durch deren hohen Auslastungsgrad limitiert[22]. Ein weiterer Aspekt sind die damit für den Tierbesitzer verbundenen Kosten, die mit der begrenzten Überlebenszeit abgewogen werden müssen. Zudem müssen die Patienten in eine Kurzzeitnarkose gelegt werden, um eine einwandfreie Positionierung zu gewährleisten. Kurative (heilende) und palliative (lindernde) Tumorbestrahlungen finden daher zumeist dort Einsatz, wo eine chirurgische Tumorresektion aus kosmetischen und anatomischen Gründen nur schwierig ist, wie beispielsweise am Kopf und den Gliedmaßen. Darüber hinaus findet auch die Radiojodtherapie Einsatz, vor allem bei der Schilddrüsenüberfunktion der Katzen.
Die häufigste Indikation sind bösartige Hauttumoren wie Karzinome, Weichteilsarkome und Mastzelltumoren. Hier wird die Strahlentherapie vor allem im Anschluss an eine chirurgische Entfernung zur Vermeidung von Rezidiven durchgeführt. Aufgrund der kosmetisch-chirurgischen Limitierung werden auch bei Tumoren der Maul- und Nasenhöhle wie Plattenepithelkarzinome, maligne Melanome, Fibrosarkome und Zahnfleischgeschwulste (akanthomatöse Epuliden) Bestrahlungen durchgeführt. Bei Tumoren im Zentralnervensystem (Gliome, Meningiome und Adenome der Hypophyse) gilt die Strahlentherapie als Mittel der Wahl. Bei Osteosarkomen der Gliedmaßen wird dagegen eine Amputation mit anschließender Chemotherapie bevorzugt, die Strahlentherapie kann hier palliativ angewendet werden, wenn der Besitzer des Tieres eine Amputation ablehnt. Maligne Lymphome sind meistens weit im Tier verstreut und Ganzkörperbestrahlungen sind kaum vertretbar, so dass hier allenfalls einzelne Herde bestrahlt werden, in der Regel mit einer Chemotherapie kombiniert.
Siehe auch |
Strahlendosis / Dosimetrie
Strahlenschutz / Strahlenschaden / Geschichte des Strahlenschutzes
Strahlenbelastung / Strahlenresistenz / Strahlenkrankheit
Einzelnachweise |
↑ M. J. Zelefsky, Y.Yamada, Z Fuks, und andere:
Long-term results of conformal radiotherapy for prostate cancer: impact of dose escalation in biochemical tumor control and distant metastases-free survival outcomes.
Journal of Radiation Oncology, Biology and Physics 2008;Band 71: S. 1028–33
↑ DGMP, DEGRO: Leitlinie zur Strahlentherapie mit fluenzmodulierten Feldern (IMRT). Version 2018: nur online
↑ Karl-Ruprechts-Universität Heidelberg IKR-Sektion Strahlentherapie: VMAT (Volumetric Intensity Modulated Arc Therapy)
↑ Patricia J Eifel: Concurrent chemotherapy and radiation therapy as the standard of care for cervical cancer. In: Nature Clinical Practice Oncology. Band 3, Nr. 5, 2006, ISSN 1759-4782, S. 248–255, doi:10.1038/ncponc0486 (nature.com [abgerufen am 2. April 2018]).
↑ Reducing Uncertainties About the Effects of Chemoradiotherapy for Cervical Cancer: A Systematic Review and Meta-Analysis of Individual Patient Data From 18 Randomized Trials. In: Journal of Clinical Oncology. Band 26, Nr. 35, 10. Dezember 2008, ISSN 0732-183X, S. 5802–5812, doi:10.1200/jco.2008.16.4368 (ascopubs.org [abgerufen am 2. April 2018]).
↑ D. Citrin, A. P. Cotrim, F. Hyodo, B. J. Baum, M. C. Krishna, J. B. Mitchell: Radioprotectors and mitigators of radiation-induced normal tissue injury. In: The Oncologist Band 15, Nummer 4, 2010, S. 360–371, ISSN 1549-490X. doi:10.1634/theoncologist.2009-S104. PMID 20413641. PMC 3076305 (freier Volltext). (Review)
↑ J. R. Kouvaris, V. E. Kouloulias, L. J. Vlahos: Amifostine: the first selective-target and broad-spectrum radioprotector. In: The oncologist Band 12, Nummer 6, Juni 2007, S. 738-747, ISSN 1083-7159. doi:10.1634/theoncologist.12-6-738. PMID 17602063. (Review)
↑ Westdeutsches Protonentherapiezentrum Essen | 500. Patient. In: www.wpe-uk.de. Abgerufen am 26. Oktober 2016.
↑ Pressemitteilung: Universitätsklinikum Essen übernimmt Westdeutsches Protonentherapiezentrum vollständig.
↑ Westdeutsches Protonentherapiezentrum Essen | Vierter Behandlungsraum eröffnet – Essener Einrichtung damit größtes Protonentherapiezentrum an einem Universitätsklinikum in Deutschland. In: www.wpe-uk.de. Abgerufen am 26. Oktober 2016.
↑ Westdeutsche Allgemeine Zeitung (WAZ) vom 29. April 2014: Die schwierige Geschichte einer Strahlenklinik
↑ J. Dunst, R. Kampf: Universitätsklinikum Schleswig-Holstein, Campus Kiel: Partikeltherapiezentrum ab 2012. (Memento des Originals vom 12. März 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.aeksh.de (PDF; 212 kB) In: Schleswig-Holsteinisches Ärzteblatt. 10, 2008, S. 63–68.
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.aeksh.de (PDF; 212 kB) In: Schleswig-Holsteinisches Ärzteblatt. 10, 2008, S. 63–68.
↑ Pressemitteilung der Philipps-Universität Marburg: "Marburger Ionenstrahl-Therapiezentrum: Im Herbst 2015 sollen die ersten Patienten bestrahlt werden" vom 23. Oktober 2014
↑ Pressemitteilung des Universitätsklinikums Heidelberg vom 27. Oktober 2015.
↑ A Gerbaulet, R Pötter, J-J Mazeron, H Meertens, E V Limbergen (Herausgeber): The GEC ESTRO Handbook of Brachytherapy. ACCO-Verlag, Leuven Belgien 2002, ISBN 90-804532-6
↑ Köhler 2007: Strahlentherapie bei benignen Erkrankungen. (PDF; 228 kB) (Memento des Originals vom 10. August 2007 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.radiologen-konstanz.de
Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.@1@2Vorlage:Webachiv/IABot/www.radiologen-konstanz.de
↑ L. B. Harrison, M. Chadha, R. J. Hill, K. Hu, D. Shasha: Impact of tumor hypoxia and anemia on radiation therapy outcomes. In: The oncologist Band 7, Nummer 6, 2002, S. 492–508, ISSN 1083-7159. PMID 12490737. (Review).
↑ W. Rhomberg, J. Dunst: Radiosensitizer. In: H. J. Schmoll, K. Höffken, K. Possinger (Hrsg.): Kompendium Internistische Onkologie Standards in Diagnostik und Therapie. Springer, 2005, ISBN 3-540-20657-4, S. 619. eingeschränkte Vorschau in der Google-Buchsuche
↑ Ryan J. Sullivan, Donald P. Lawrence, Jennifer A. Wargo, Kevin S. Oh, R. Gilberto Gonzalez, Adriano Piris: Case 21-2013 – A 68-Year-Old Man with Metastatic Melanoma The New England Journal of Medicine 2013, Band 369, Ausgabe 2 vom 11. Juli 2013, Seiten 173–183; doi:10.1056/NEJMcpc1302332
↑ Sarah C. Darby, Marianne Ewertz, Paul McGale, Anna M. Bennet, Ulla Blom-Goldman, Dorthe Brønnum, Candace Correa, David Cutter, Giovanna Gagliardi, Bruna Gigante, Maj-Britt Jensen, Andrew Nisbet, Richard Peto, Kazem Rahimi, Carolyn Taylor, Per Hall: Risk of Ischemic Heart Disease in Women after Radiotherapy for Breast Cancer. New England Journal of Medicine 2013, Band 368, Ausgabe 11 vom 14. März 2013, Seiten 987–998, doi:10.1056/NEJMoa1209825
↑ Tabelle der Bundesärztekammer 2008: Ärztinnen/Ärzte nach Bezeichnungen und ärztlichen Tätigkeitsbereichen. (PDF)
↑ Hirschfeld D, et al.: Strahlentherapie in der Kleintiermedizin. Praktischer Tierarzt 82:1, 16–21 (2001) (PDF; 29 kB)
Literatur |
- M. Bamberg, M. Molls, H. Sack (Hrsg.): Radioonkologie 1 – Grundlagen, 2. Aufl., Zuckschwerdt Verlag München, ISBN 978-3-88603-946-3, 2009.
- M. Bamberg, M. Molls, H. Sack (Hrsg..): Radioonkologie 2 – Klinik, 2. Aufl., Zuckschwerdt Verlag München, ISBN 978-3-88603-953-1, 2009.
- Michael Wannenmacher, Jürgen Debus, Frederik Wenz (Hrsg.): Strahlentherapie. Springer, Berlin 2006. ISBN 3-540-22812-8 (Lehrbuch).
- Rolf Sauer: Strahlentherapie und Onkologie. Urban & Fischer bei Elsevier, 2002, ISBN 3-437-47500-2 (Lehrbuch).
- Alain Gerbaulet u. a. (Hrsg.): The GEC/ESTRO Handbook of Brachytherapy. Arnold Australia 2003. ISBN 0-340-80659-1, Volltext online (Lehr- und Handbuch, englisch).
- Carlos A. Perez, Luther W. Brady, Edward C. Halperin (Hrsg.): Principles and Practice of Radiation Oncology. Lippincott, New York 2003. ISBN 0-7817-3525-4 (Lehrbuch, englisch).
- Jane Dobbs, Ann Barrett, Dan Ash: Practical Radiotherapy Planning. Hodder Arnold, 1999, ISBN 0-340-70631-7, (Lehrbuch zur Teletherapie-Bestrahlungsplanung, englisch).
- Barbara Kaser-Hotz und Bettina Kandel: Strahlentherapie. In: Suter, Kohn (Hrsg.): Praktikum der Hundeklinik. Paul Parey Verlag, 10. Auflage 2006, S. 1115–1118. ISBN 3-8304-4141-X.
- Eckart Richter, Thomas Feyerabend: Grundlagen der Strahlentherapie. 2. Auflage, Springer, Berlin 2002. ISBN 3-540-41265-4.
- Boris Peter Selby, Stefan Walter, Georgios Sakas, Uwe Stilla: Automatic Geometry Calibration of X-Ray Equipment for Image Guided Radiotherapy. In: Particle Therapy Co-Operative Group (PTCOG) Proceedings. Jacksonville, Bd. 47, 2008, S. 119.
Weblinks |
- Deutsche Gesellschaft für Radioonkologie
- Deutsche Gesellschaft für Medizinische Physik
- European Society for Therapeutic Radiology and Oncology
Protonen-Therapie am Paul Scherrer Institut
Biophysik am GSI Helmholtzzentrum für Schwerionenforschung- Heidelberger Ionenstrahl-Therapiezentrum (HIT)
- Marburger Ionenstrahl-Therapiezentrum (MIT)
- Biologische Äquivalenzdosis-Rechner
- Broschüre für Strahlentherapie-Patienten, deren Angehörige und alle Interessierte
| Dieser Artikel behandelt ein Gesundheitsthema. Er dient nicht der Selbstdiagnose und ersetzt keine Arztdiagnose. Bitte hierzu den Hinweis zu Gesundheitsthemen beachten! |